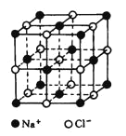
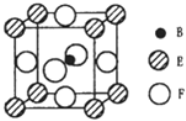
题目内容
【题目】298K时,向20mL 0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是
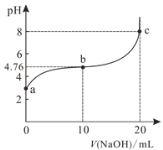
A.a点溶液的pH为2.88
B.b点溶液中:c(Na+)>c(A-)>c(HA)
C.b、c之间一定存在c(Na+)=c(A-)的点
D.a、b、c三点中,c点水的电离程度最大
【答案】B
【解析】
A.当加入10mL0.1mol/LNaOH溶液时,溶液中c(HA)=c(A-) ,由HAH++A-可知Ka=![]() =c(H+)=10-4.76,则0.1mol/L的某酸HA中的c(H+)可用三段式进行计算,设电离的c(HA)为xmol/L:
=c(H+)=10-4.76,则0.1mol/L的某酸HA中的c(H+)可用三段式进行计算,设电离的c(HA)为xmol/L:

HA的电离平衡常数K=![]() =
=![]() =10-4.76,剩余的c(HA)=0.1-x≈0.1mol/L,解得x=10-2.88,所以a点溶液的pH为2.88,A正确;
=10-4.76,剩余的c(HA)=0.1-x≈0.1mol/L,解得x=10-2.88,所以a点溶液的pH为2.88,A正确;
B.b溶液显酸性,c(H+)>(OH-),由电荷守恒可知c(Na+)<c(A-),B错误;
C.溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),当溶液pH=7呈中性时c(H+)=c(OH-),则c(Na+)=c(A-),所以b、c之间一定存在c(Na+)=c(A-)的点,C正确;
D.a、b点中溶液显酸性, HA电离出的H+对水的电离起抑制作用,c点酸碱恰好完全反应生成盐NaA,对水的电离起促进的作用,所以a、b、c三点中,c点水的电离程度最大,D正确;
答案选B。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】在古代,橘红色的铅丹(Pb3O4)用于入药和炼丹,人们对其中重金属铅的毒性认识不足。已知:PbO2为棕黑色粉末。某化学兴趣小组对铅丹的一些性质进行实验探究并测定其组成。
回答下列问题:
(1)性质实验
实验操作 | 现象 | 解释或结论 |
①将适量铅丹样品放入小烧杯中,加入2mL6mol/L的HNO3溶液,搅拌 | _____ | Pb3O4+4HNO3=PbO2+ 2Pb(NO3)2+2H2O |
②将上述混合物过滤,所得滤渣分为两份,一份加入2mL浓盐酸,加热 | 有刺激性的黄绿色气体产生 | 反应的化学方程式: _______ |
③另一份滤渣加入硝酸酸化的Mn(NO3)2溶液,搅拌 | 得紫色溶液 | 结论:_______ |
(2)组成测定
①准确称取0.530g干燥的铅丹样品,置于洁净的小烧杯中,加入2mL6mol/L的HNO3溶液,搅拌使之充分反应,分离出固体和溶液。该分离操作名称是_____________。
②将①中所得溶液全部转入锥形瓶中,加入指示剂和缓冲溶液,用0.04000mol/L的EDTA溶液(显酸性)滴定至终点,消耗EDTA溶液36.50mL。EDTA与Pb2+的反应可表示为Pb2++H2Y2-=PbY2-+2H+,滴定时EDTA溶液应盛装在_______________中。滤液中含Pb2+__________mol。
③将①中所得固体PbO2全部转入另一锥形瓶中,往其中加入适量HAc与NaAc的混合液和8g固体 KI,摇动锥形瓶,使PbO2全部反应而溶解,发生反应PbO2+4I-+4HAc =PbI2+I2+4Ac-+2H2O,此时溶液呈透明棕色。以0.05000mol/L的Na2S2O3标准溶液滴定,发生反应I2+2S2O32-=S4O62-+2I-,至溶液呈淡黄色时加入2%淀粉溶液1mL,继续滴定至溶液_______,即为终点,用去Na2S2O3溶液30.80mL。
根据②、③实验数据计算,铅丹中Pb(Ⅱ)与Pb(Ⅳ)的原子数之比为____________。