题目内容
11.Ⅰ.请回答:(1)H2O2的电子式
 .
.(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO.
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式AgCl+Br-=AgBr+Cl-.
(4)完成以下氧化还原反应的离子方程式:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O.
Ⅱ.化合物甲和NaAlH4都是重要的还原剂.一定条件下金属钠和H2反应生成甲.甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4.将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况)的H2.
请推测并回答:
(1)甲的化学式NaH.
(2)甲与AlCl3反应得到NaAlH4的化学方程式4NaH+AlCl3=NaAlH4+3NaCl.
(3)NaAlH4与水发生氧化还原反应的化学方程式NaAlH4+2H2O=NaAlO2+4H2↑.
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式3NaH+Fe2O3=2Fe+3NaOH.
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到的固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的.
判断该同学设想的制备和验纯方法的合理性并说明理由制备过程不合理,因为盐酸易挥发,氢气中混有HCl,导致产物中有NaCl;
验纯方法不合理,如果有Na残留,Na与水反应也产生氢气,且没有考虑混入的NaCl.
分析 I、(1)双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
(2)高温下,Mg与二氧化碳反应生成易燃的MgO;
(3)AgBr的溶解度小于AgCl溶解度,向AgCl沉淀中加入KBr溶液发生了沉淀的转化;
(4)依据氧化还原反应得失电子守恒,结合元素守恒和电荷守恒书写即可;
II、(1)钠元素在化合物中只能形成+1价,据此结合生成氢气的物质的量判断其化学式即可;
(2)NaH与AlCl3反应可得到NaAlH4,此反应无化合价的变化,据此书写;
(3)NaAlH4与水反应生成氢气,应是水中的H元素与NaH中的H元素之间得失电子,据此书写即可;
(4)由题意可知NaH常做还原剂那么铁锈为氧化剂,反应生成铁单质,据此书写;
(5)制备过程中未指明吸收杂质气体HCl,据此解答;氢气与金属钠反应未指明钠的用量,钠可能过量,过量的钠也可以与水反应生成氢气.
解答 解:I、(1)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故答案为:
,故答案为: ;
;
(2)高温下,Mg与二氧化碳反应生成MgO,化学反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO,不能起到灭火的作用,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO;
(3)AgCl沉淀中加入KBr溶液,生成了更难溶的AgBr沉淀,离子反应方程式为:AgCl+Br-=AgBr+Cl-,故答案为:AgCl+Br-=AgBr+Cl-;
(4)此反应中Mn由+7价降低到+2价,得到5个电子,C由+3价升高到+4价失去1个电子,2个C失去2个电子,故高锰酸根与草酸根的化学计量数分别为2和5,据此配平得2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O,故答案为:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O;
II、(1)Na在化合价中呈现+1价,故该物质的化学式可能为NaH,又甲与AlCl3反应可得到NaAlH4,Al的化合价为+3,故H元素的化合价为-1,4.80g甲加热至完全分解,得到金属钠和2.24L,即0.1mol氢气,化学反应方程式为:2NaH$\frac{\underline{\;加热\;}}{\;}$2Na+H2↑
48g 22.4L
4.8g 2.24L
故此化合物为NaH,故答案为:NaH;
(2)NaH与AlCl3反应可得到NaAlH4,此反应无化合价的变化,根据原子守恒推测另一种生成物,化学反应方程式为:4NaH+AlCl3=NaAlH4+3NaCl,故答案为:4NaH+AlCl3=NaAlH4+3NaCl;
(3)NaAlH4与水反应生成氢气,即NaH中H化合价升高,水中H元素化合价降低,化学反应方程式为:NaAlH4+2H2O=NaAlO2+4H2↑,故答案为:NaAlH4+2H2O=NaAlO2+4H2↑;
(4)NaH常做还原剂(H化合价升高为+1价),铁锈在此为氧化剂(Fe化合价降低为0价),反应生成铁单质,化学反应方程式为:3NaH+Fe2O3=2Fe+3NaOH,故答案为:3NaH+Fe2O3=2Fe+3NaOH;
(5)稀盐酸具有挥发性,且可以利用浓硫酸干燥,故制取的氢气中可能混有杂质气体HCl,那么制取的甲中就混有NaCl,验证过程中未排除金属钠的干扰,过量的金属能也可以与水反应生成氢气.
故答案为:制备过程不合理,因为盐酸易挥发,氢气中混有HCl,导致产物中有NaCl;
验纯方法不合理,如果有Na残留,Na与水反应也产生氢气,且没有考虑混入的NaCl.
点评 本题主要考查的是常见元素以及其化合物的知识,综合性较强,涉及电子式的书写、物质的判断、氧化还原反应的是电子守恒、化学反应方程式书写、实验方案的评价等,难度较大.

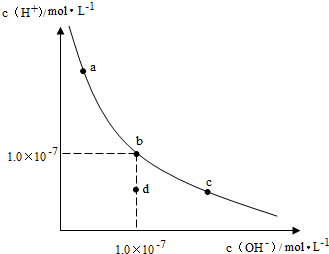
| A. | 升高温度,可能引起由c向b的变化 | |
| B. | 该温度下,水的离子积常数为1.0×10-13 | |
| C. | 该温度下,加入FeCl3可能引起由b向a的变化 | |
| D. | 该温度下,稀释溶液可能引起由c向d的变化 |
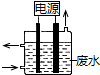 用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式:2H2O+2e-═H2↑+2OH- | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O |
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | 元素X、Z、W的最高化合价分别与其主族序数相等 |
| A. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 聚合物(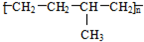 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 |
| A. | AlCl3 | B. | Na2O | C. | FeCl2 | D. | SiO2 |
| A. | 18O2和16O2是两种不同的原子 | B. | 甲醇(CH3OH)属于离子化合物 | ||
| C. | N5和N2是氮元素的两种同位素 | D. | 由N5变成N2是化学变化 |


 .
.
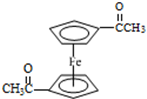 ),可以使用的仪器分析方法是质谱法或核磁共振氢谱.
),可以使用的仪器分析方法是质谱法或核磁共振氢谱.