题目内容
19. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | 元素X、Z、W的最高化合价分别与其主族序数相等 |
分析 短周期元素w的质子数是其最外层电子数的三倍,则W是P元素,根据元素在周期表中的位置关系可确定:X是N元素,Y是O元素,Z是Si元素,由此分析解答.
解答 解:A、同一周期的元素,原子序数越大,原子半径越小,不同周期的元素,原子核外电子层数越多,原子半径就越大,所以原子半径大小关系是:Z>W>X>Y,故A错误;
B、元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,元素的非金属性:X>W>Z,所以它们的最高价氧化物对应水化物的酸性:X>W>Z,故B正确;
C、元素的非金属性越强,其相应的氢化物的稳定性就越强,元素的非金属性:Y>X>W>Z,所以元素的氢化物的稳定性:Y>X>W>Z,故C正确;
D、主族元素除了O和F之外,最高化合价等于主族序数,所以X、Z、W的最高化合价分别与其主族序数相等,故D正确;
故选A.
点评 本题考查元素的推断、元素周期表、元素周期律的应用的知识,学生只要熟悉元素周期表,确定元素的种类是解题的关键,比较容易.

练习册系列答案
相关题目
9.下列溶液中与1L 0.1mol•L-1 NaCl溶液混合,所得中c(Cl-)最大的是( )
| A. | 50mL 1mol•L-1 NaCl溶液 | B. | 20mL 2mol•L-1 AlCl3溶液 | ||
| C. | 30mL 1mol•L-1 MgCl2溶液 | D. | 100mL 3mol•L-1 NaClO3溶液 |
10.下列关于自然界中氮循环(如图)的说法不正确的是( )
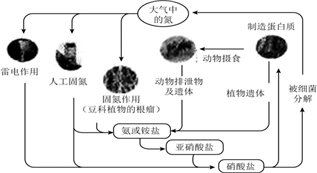

| A. | 氮元素均被氧化 | |
| B. | 工业合成氨属于人工固氮 | |
| C. | 含氮无机物和含氮有机物可相互转化 | |
| D. | 碳、氢、氧三种元素也参加了氮循环 |
7.下列说法正确的是( )
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | Al2O3和MgO均可与NaOH溶液反应 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
4.下列说法正确的是( )
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较低温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |


 .
.

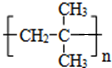 .
.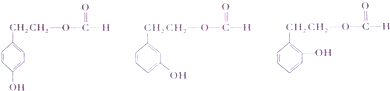 .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.