题目内容
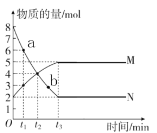
【题目】CH4是一种重要的化工原料,工业上以CH4为原料制备H2的原理为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1molH2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b。已知容器a的体积为10L,温度为Ta。下列说法正确的是( )
CO(g)+3H2(g)。在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1molH2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b。已知容器a的体积为10L,温度为Ta。下列说法正确的是( )

A.a、b两容器的温度不可能相同
B.在达到平衡前,容器a的压强保持不变
C.该反应在Ta温度下的平衡常数为2700(mol·L-1)2
D.容器a中CH4从反应开始到恰好平衡时的平均反应速率为0.25mol·L-1·min-1
【答案】A
【解析】
通过图像可知,平衡时a装置中的CO的物质的量比b装置中的CO的物质的量大,反应时间短,说明a中化学反应速率较大。在两容器中起始投料相同的条件下,加快化学反应速率的措施有升高温度和增大压强两种方法。若a中压强较大,则相对于b来说,平衡逆向移动,CO的物质的量会小于b,故不可能;若a中温度高于b,相对于b来说,平衡正向移动,CO的浓度增大,则该反应的△H>0,有可能。
A.通过图像可知,平衡时a装置中的CO的物质的量比b装置中的CO的物质的量大,反应时间短,说明a中化学反应速率较大。在两容器中起始投料相同的条件下,加快化学反应速率的措施有升高温度和增大压强两种方法。若a中压强较大,则相对于b来说,平衡逆向移动,CO的物质的量会小于b,故不可能;若a中温度高于b,相对于b来说,平衡正向移动,CO的浓度增大,则该反应的△H>0,有可能。综上所述,a、b两容器中的温度不可能相同,A正确;
B.a为恒温恒容装置,压强与物质的量成正比,反应前反应物减少,生成物增多,总物质的量增大,压强增大,B错误;
C. CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
初始量 1.1 1.1 0 0
反应量 1 1 1 3
平衡量 0.1 0.1 1 3 K=0.1×0.33/(0.01×0.01)=27,C错误;
D. 容器a中CH4从反应开始到恰好平衡时的平均反应速率=1/(10×4)=0.025 mol·L-1·min-1,D错误;
答案为A

【题目】甲醇是重要的化工原料,利用煤化工中生产的CO、CO2和H2可制取甲醇等有机物,发生的反应有:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJmol-1
CH3OH(g) △H1=-99kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
相关物质的化学键键能数据如下:CH3OH结构式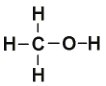
化学键 | C=O(CO2) | H—H | C—O | H—O | C—H |
E/(kJ·mol-1) | 803 | 436 | 343 | 465 | 413 |
(1)该反应△H2=____________。
(2)关于反应①下列说法,正确的是____________。
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(3)在某温度下,将1.0moCO与2.0molH2充入2L的空钢瓶中,发生反应①,在第5min时达到化学平衡状态,此时甲醇的物质的量分数为0.1。在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化状况如图所示:

①从反应开始到5min时,生成甲醇的平均速率为____________。
②H2的平衡转化率α=____________%,化学平衡常数K=____________。
③1min时,υ正____________υ逆(填“大于”“小于”或“等于”)
④1mim时υ正____________4min时υ逆(填“大于”“小于”或“等于”)
⑤比较甲醇在7~8min、12~13min和25~27min时平均反应速率[平均反应速率分别以υ(7~8)、υ(12~13)、υ(25~27)表示的大小____________。
⑥若将钢瓶换成同容积的绝热容器,重复上述试验,平衡时甲醇的物质的量分数____________0.1(填“>”、“<”或“=”)。
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
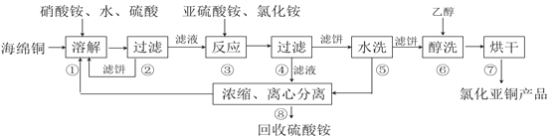
回答下列问题:
(1)步骤①中得到的氧化产物是_________,溶解温度应控制在60~70度,原因是__________。
(2)写出步骤③中主要反应的离子方程式___________。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是______________________________。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有__________(填字母)
A.分馏塔 | B.离心机 | C.反应釜 | D.框式压滤机 |
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。