题目内容
(10分)实验室利用如图装置进行中和热的测定。
回答下列问题:①如图装置中,为了酸碱能更充分地反应,应该增加一个 (填玻璃仪器名称);大烧杯上没有盖上硬纸板,测得的中和热数值将会 (填“偏大”、“偏小”或“无影响”)。
②在操作正确的前提下提高中和热测定的准确性的关键是 ( 填代号)
A.进行实验时的气温 B.装置的保温隔热效果 C.实验所用酸碱溶液的体积
③如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将 (填“偏大”、“偏小”、“不变”);原因是 。
环形搅拌器(或环形玻璃棒) 偏小 B 偏大 固体NaOH溶于水放热
解析试题分析:①如图装置中,为了酸碱能更充分地反应,应该增加一个环形玻璃搅拌器。若大烧杯上没有盖上硬纸板,就会有一部分热量散失,使测得的中和热数值将会偏小;②在操作正确的前提下提高中和热测定的准确性的关键是B.装置的保温隔热效果,减少热量损失。因此选项是B;③由于NaOH固体在水中溶解会放出热量,所以如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将偏大;
考点:考查中和热的测定的存在应该注意的问题、仪器的使用及误差分析的知识。

为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液。②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。写出②中反应的化学方程式__________________________。
(2)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是 (填序号)。
| A.烷烃 | B.烯烃 | C.炔烃 | D.苯的同系物 |
 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。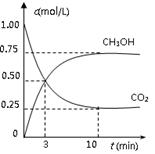
从反应开始到平衡,v(H2)= ;氢气的转化率= ;能使平衡体系中n(CH3OH)增大的措施有__________________________________________________。
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) +2O2(g)=CO2(g)+2H2O(l) △H1="―890.3" kJ/mol
H2(g) + 1/2O2(g)=H2O(l) △H2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是____________________。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是 (填“Ca(OH)2”或“Ba(OH)2”)溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定 。
除去杂质后的水煤气主要含H2、CO,是理想的合成甲醇的原料气。
(1)生产水煤气过程中有以下反应:①C(s)+CO2(g)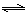 2CO(g) △H1;
2CO(g) △H1;
②CO(g)+H2O(g)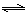 H2(g)+CO2(g) △H2;③C(s)+H2O(g)
H2(g)+CO2(g) △H2;③C(s)+H2O(g)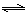 CO(g)+H2(g) △H3;
CO(g)+H2(g) △H3;
上述反应△H3与△H1、△H2之间的关系为 。
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:2CH4(g)+3O2(g) 4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 ;
(3)请在答题卡中,画出(2)中反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(4)合成气合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。
CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。
此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.20 | 0.10 | 0.40 |
①该时间段内平均反应速率v(H2)= 。
②比较此时正、逆反应速率的大小:v(正) v (逆)(填“>”、“<”或“=”)
(5)生产过程中,合成气要进行循环,其目的是 。
某实验小组用0.5mol/LNaOH溶液和0.5mol/L硫酸溶液反应进行中和热的测定。
Ⅰ.配制0.5mol/LNaOH溶液。
(1)若实验中大约要使用245mlNaOH溶液,至少需要称量NaOH固体 g。
(2)从下列仪器中选择称量NaOH固体所需的仪器(填字母) 。
a.托盘天平(带砝码)b.小纸片c.小烧杯d.坩埚钳 e.玻璃棒 f.药匙 g.量筒
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示: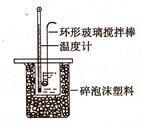
(1)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(2)取50mlNaOH溶液和30ml硫酸溶液进行实验,实验数据如表所示。
①请填写表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/ml,中和后生成溶液的比热容
C=4.18J/(g.℃)。则中和热△H= (取小数点后一位)。
③上述实验结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯
d.用量筒量取NaOH溶液的体积时仰视读数
恒温恒容的容器内,不可作为可逆反应I2(g)+H2(g) 2HI(g)达到平衡状态的标志的是
2HI(g)达到平衡状态的标志的是
| A.1 mol H—H键断裂,同时有2 mol H—I键断裂 | B.容器内气体的总压强不再变化 |
| C.H2的物质的量浓度不再变化 | D.混合气体的颜色不再变化 |
下列各表述与示意图一致的是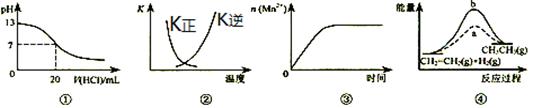
| A.图①表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②曲线表示反应2SO2(g)+O2(g) 2SO3(g);△H﹤0正、逆反应的平衡常数K随温度的变化 2SO3(g);△H﹤0正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10mL0.01mol?L-1KMnO4酸性溶液与过量的0.1mol?L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |

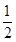 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2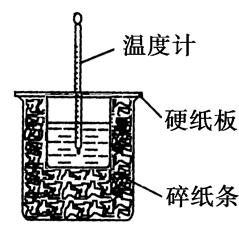
 A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是