题目内容
【题目】工业上电解制碱的技术是用离子交换膜法。请回答下列问题:
(1)电解精制食盐水,电解槽中的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许阳离子通过,而不允许_____________(填离子符号)和气体通过。
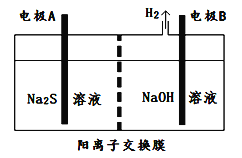
(2)氯碱工业中获得的烧碱可以吸收有毒气体H2S,吸收后的溶液加入到如图所示的电解池的阳极区进行电解以获取单质硫。
①Na2S溶液显碱性的原因(离子方程式):____________________________________________________________。
②电极A应该与直流电源的____________相连。A电极反应为________________________________________________。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节电、节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出。
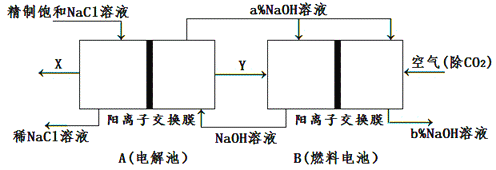
①图示中电极产物X、Y分别是____________、____________(填化学式)。图示中氢氧化钠溶液质量分数大小:a%______b%(填“﹥”“﹤”或“=”)。
②燃料电池B中正极的电极反应:_________________________________________________________。
【答案】 Cl- OH- S2-+H2O![]() HS-+OH- 正极 S2--2e-=S Cl2 H2 ﹤ O2+4e-+2H2O=4OH-
HS-+OH- 正极 S2--2e-=S Cl2 H2 ﹤ O2+4e-+2H2O=4OH-
【解析】试题分析:(1)阳离子交换膜只允许阳离子通过,而不允许阴离子、气体通过;(2)①Na2S是强碱弱酸盐,S2-水解;②S2-在A极失电子生成S单质;(3)①根据阳离子交换膜的作用和燃料电池的工作原理来回答;②根据燃料电池的工作原理来回答;
解析:(1)阳离子交换膜只允许阳离子通过,而不允许阴离子Cl- 、OH-和气体通过;(2)①Na2S是强碱弱酸盐,S2-水解溶液呈碱性,水解方程式是S2-+H2O![]() HS-+OH-;②S2-在A极失电子生成S单质,所以A应该与直流电源的正极相连,电极反应式为S2--2e-=S;(3)(3)①在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,所以Y是氢气,即产生Y的极是阴极,产生X的电极是阳极,阳极氯离子失电子生成氯气,X是氯气;燃料电池的正极是氧气得电子在碱性条件下生成氢氧根离子,钠离子通过阳离子膜进入正极区生成氢氧化钠,所以氢氧化钠浓度增大,a%<b%;②燃料电池的正极是氧气得电子在碱性条件下生成氢氧根离子,电极反应式是O2+4e-+2H2O=4OH-;
HS-+OH-;②S2-在A极失电子生成S单质,所以A应该与直流电源的正极相连,电极反应式为S2--2e-=S;(3)(3)①在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,所以Y是氢气,即产生Y的极是阴极,产生X的电极是阳极,阳极氯离子失电子生成氯气,X是氯气;燃料电池的正极是氧气得电子在碱性条件下生成氢氧根离子,钠离子通过阳离子膜进入正极区生成氢氧化钠,所以氢氧化钠浓度增大,a%<b%;②燃料电池的正极是氧气得电子在碱性条件下生成氢氧根离子,电极反应式是O2+4e-+2H2O=4OH-;

 名校课堂系列答案
名校课堂系列答案