题目内容
【题目】海洋资源应用非常广泛,从中可提取氯化钠、碘等化工产品。回答下列问题:
I.实验室用氯化钠固体配制1.0molL-1的食盐水500mL。
(1)所需仪器为容量瓶(规格为____)、托盘天平、烧杯、玻璃棒和_____。
(2)配制时,下列操作对所配溶液的浓度有何影响?(填字母)无影响的有_____,偏大的有______,偏小的有_______。
A.称量时使用了生锈的砝码
B.往容量瓶中移液时,有少量液体溅出
C.容量瓶未干燥即用来配制溶液
(3)若加蒸馏水定容时不慎超过了刻度线,应如何处理?_______
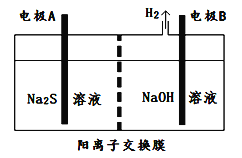
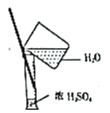
II.海藻中含有丰富的碘元素,某课外活动小组欲从海藻中提取碘(已知过程②中反应的离子方程式为2I—+C12=2C1—+I2),设计如下的流程:

(4)指出提取碘的过程中有关实验操作的名称:①_______,③______。
(5)提取碘的过程中,可选择的有机溶剂是______。
A.酒精 B.醋酸 C.苯
【答案】500mL 胶头滴管 C A B 应倒掉溶液,洗涤容量瓶,重新配制 过滤 萃取 C
【解析】
I.(1)实验配制500mL1.0molL-1的NaCl溶液,所以还需要500mL容量瓶;根据实验操作的步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等操作,来分析。
(2)根据c= n /V 分析可知。
(3)加蒸馏水时不慎超过了刻度线,溶液的体积偏大,所配溶液浓度偏低,无法补救,应倒掉溶液,洗涤容量瓶,重新配制。
II.(4)根据已知过程②中反应的离子方程式为2I—+C12=2C1—+I2和流程分析。
(5)因为苯不溶于水,碘在苯中溶解度远大于在水中的溶解度,酒精、醋酸与水都互溶。
I.(1)实验配制500mL1.0molL-1的NaCl溶液,所以还需要500mL容量瓶;
实验操作的步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等操作,该实验中需要用天平称量、用药匙取药品,烧杯溶解药品,需要玻璃棒搅拌和引流,需要500mL容量瓶配制溶液,最后需要胶头滴管定容,故答案为:500mL;胶头滴管。
(2)A.称量时使用了生锈的砝码,溶质的质量偏大,物质的量偏大,根据c= n /V 分析可知,所配溶液的浓度偏大;
B.往容量瓶中移液时,有少量液体溅出,溶质的质量偏小,物质的量偏小,根据c= n/ V 分析可知,所配溶液的浓度偏小;
C. 容量瓶未干燥即用来配制溶液,对溶液的体积和物质的量无影响,所配溶液的浓度不变。故答案为:C;A;B。
(3)加蒸馏水时不慎超过了刻度线,溶液的体积偏大,所配溶液浓度偏低,无法补救,应倒掉溶液,洗涤容量瓶,重新配制,故答案为:应倒掉溶液,洗涤容量瓶,重新配制。
II.(4)①是过滤操作,已知过程②中反应的离子方程式为2I—+C12=2C1—+I2,③中加入了有机溶剂,萃取溶液中的I2,故操作为萃取,故答案为:过滤;萃取。
(5)提取碘的过程中,可选择的有机溶剂是苯,因为苯不溶于水,碘在苯中溶解度远大于在水中的溶解度,酒精、醋酸与水都互溶,故选C。

 阅读快车系列答案
阅读快车系列答案【题目】以反应5H2C2O4+2MnO4-+6H+===10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
下列说法不正确的是
A. 实验①、②、③所加的H2C2O4溶液均要过量
B. 实验①测得KMnO4溶液的褪色时间为40 s,则这段时间内平均反应速率υ(KMnO4)=2.5×10-4mol·L-1·s-1
C. 若生成a L CO2(标准状况),该反应转移的电子数为aNA/22.4
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用