题目内容
【题目】氨和肼(N2H4)都是氮元素的重要氢化物,在工农业生产、生活中有广泛应用。
(1)工业中常用以下反应合成氨:N2+3H2![]() 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
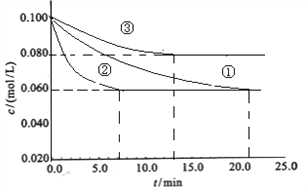
装罝③仅有一个反应条件与①不同,该条件为_______________,实验②平衡时H2的转化率为_____________;
(2)肼是一种具有强还原性的无色油状液体,可用作燃料。
①在火箭推进器中装有胼(N2H4)和液态H2O2,已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量。该反应的热化学方程式为_____________________________________________________。
②肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。已知肼在101kPa、25℃条件下的燃烧热为624kJ·mol-1,如果此燃料电池的能量转化率为50%,当消耗空气2.24L(已折算为标准状况下体积)时,则此电池产生的电能约为_________kJ。(假设空气中氧气的体积含量为20%,产物为液态水)

(3)肼又称“联氨”,为二元弱碱,在水中的电离方程式与氨相似,肼第一步电离反应的平衡常数值为____________.(已知:N2H4+H+![]() N2H5+ 的K=8.7×107;KW =1.0×10-14)
N2H5+ 的K=8.7×107;KW =1.0×10-14)
【答案】 (升高)温度 40% N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-641.5kJ·mol-1 6.24kJ ![]()
【解析】(1)③到达平衡的时间比①短,到达平衡时N2的浓度高于①,与①相比,平衡向逆反应方向移动,故③与①相比温度升高,即该条件为升高温度;实验②平衡时H2的转化率为α(H2)=![]() ×100%=
×100%=![]() ×100%=40%;(2)①已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量,则1mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出641.5kJ的热量,该反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-641.5kJ·mol-1;②根据热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol,消耗标准状况下的空气2.24L(假设空气中氧气体积含量为20%)时,即消耗氧气是0.02mol,此燃料电池的能量转化率为50%时,电池产生的电能为624kJ×0.02×50%=6.24kJ;(3)联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离的方程式为N2H4+H2O
×100%=40%;(2)①已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量,则1mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出641.5kJ的热量,该反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-641.5kJ·mol-1;②根据热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol,消耗标准状况下的空气2.24L(假设空气中氧气体积含量为20%)时,即消耗氧气是0.02mol,此燃料电池的能量转化率为50%时,电池产生的电能为624kJ×0.02×50%=6.24kJ;(3)联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离的方程式为N2H4+H2O![]() N2H5++OH-,已知:N2H4+H+
N2H5++OH-,已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14,平衡常数K=8.7×107×1.0×10-14=8.7×10-7 。
N2H5+的K=8.7×107;KW=1.0×10-14,平衡常数K=8.7×107×1.0×10-14=8.7×10-7 。