题目内容
10. 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少;甲池中发生的反应为:CH4+2O2+2KOH═K2CO3+3H2O.回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少;甲池中发生的反应为:CH4+2O2+2KOH═K2CO3+3H2O.回答下列问题:(1)M电极材料是铁,N电极的电极反应式为4OH--4e-=O2↑+2H2O,通入甲烷的铂电极上发生的电极反应式为CH4-8e-+10OH-=CO32-+7H2O.
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗标准状况下的氧气体积为0.224L;若此时乙池溶液的体积为400mL,则乙池溶液中的H+的物质的量浓度为0.1mol/L.
分析 (1)碱性乙醇电池为原电池,通入乙醇的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,根据图片知,N是阳极,M是阴极,工作时M、N两个电极的质量都不减少,则M电极是铁,N电极是石墨,根据燃料电池和电解池的工作原理回答;
(2)电解硝酸银溶液时,阴极反应式为Ag++e-=Ag,阳极反应式为4OH--4e-=O2↑+2H2O,结合电子的转移的物质的量的判断进行计算.
解答 解:(1)碱性乙醇电池为原电池,通入乙醇的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,根据图片知,N是阳极,M是阴极,工作时M、N两个电极的质量都不减少,则M电极是铁,N电极是石墨,通过以上分析知,M是阴极,N极是阳极,N上电极反应式为4OH--4e-=O2↑+2H2O,甲烷是燃料电池的负极,发生失电子的氧化反应,碱性环境下,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O,故答案为:铁;4OH--4e-=O2↑+2H2O;CH4-8e-+10OH-=CO32-+7H2O.
(2)n(Ag)=$\frac{4.32g}{108g/mol}$=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e-=4H2O,则消耗n(O2)=$\frac{1}{4}$×0.04mol=0.01mol,V(O2)=0.01mol×22.4L/mol=0.224L;乙池中某一电极析出金属银4.32g时,同时产生氢离子的物质的量是0.04mol,则其浓度是0.1mol/L,故答案为:0.224,0.1mol/L.
点评 本题考查了原电池原理和电解池原理,明确原电池和电解池电极上发生反应的类型即可分析解答本题,难度不大,注意电极反应式的书写与电解质溶液的酸碱性有关.

| A. | CH3COONa═CH3COO-+Na+ | B. | H2SO4═H2++SO42- | ||
| C. | FeCl3═Fe2++3Cl- | D. | KClO3═K++3O2-+Cl- |
| A. | Zn与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | 金属铜与稀盐酸反应:Cu+2H+═Cu2++H2↑ | |
| C. | Ca(OH)2溶液与Na2CO3溶液反应:Ca2++CO${\;}_{3}^{2-}$═CaCO3↓ | |
| D. | 氧化铁与稀盐酸反应:Fe2O3+6H+═2Fe3++3H2O |
| A. | 标准状况下56g铁原子 | B. | 20℃、101kPa时36.5gHCl | ||
| C. | 标准状况下6.02×1023个NH3 | D. | 标准状况下1molC2H5OH |
| A. | 在标准状况下,33.6L SO3中含有的原子数目为6NA | |
| B. | 1L 1mol/L醋酸溶液中,H+数目小于NA | |
| C. | 等体积、等质量的CO和N2具有相同的电子数目 | |
| D. | 1mol Fe与足量的氯气反应转移的电子数目为3NA |
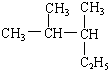 2,3-二甲基戊烷
2,3-二甲基戊烷 .
.