题目内容
【题目】下列各组离子在指定的溶液中能大量共存的是( )
①常温下pH=1的溶液中:![]()
②![]() 溶液:
溶液:![]()
③中性透明溶液中:![]()
④加入Al能放出H2的溶液中:![]()
⑤能使红色石蕊试纸变为蓝色的溶液:![]()
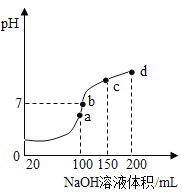
⑥25℃时![]() 的溶液:
的溶液:![]()
A.②③B.①⑥C.③④⑤D.①⑤⑥
【答案】B
【解析】
①常温下pH=1的溶液为酸性,溶液中:![]() 能大量共存,故①符合题意;
能大量共存,故①符合题意;
②![]() 溶液:硫离子和铝离子发生相互促进的水解反应,所以不能共存,故②不符合题意;
溶液:硫离子和铝离子发生相互促进的水解反应,所以不能共存,故②不符合题意;
③Fe3+发生水解反应,在中性溶液中不能大量共存,故③不符合题意;
④加入Al能放出H2的溶液可能是酸性溶液,也可能是碱性溶液,![]() 在两种溶液中都不能大量共存,故④不符合题意;
在两种溶液中都不能大量共存,故④不符合题意;
⑤能使红色石蕊试纸变为蓝色的溶液显碱性,碱性溶液中次氯酸根离子也有极强的氧化性,能把硫离子直接氧化成硫酸根离子:不能大量共存,故⑤不符合题意;
⑥25℃时![]() 的溶液显碱性,在碱性溶液中:
的溶液显碱性,在碱性溶液中:![]() 能大量共存,故⑥符合题意;
能大量共存,故⑥符合题意;
所以符合题意的选项为①⑥。
答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】新能源汽车的大力推广,带动锂电池材料的发展。我国科学家研发出利用钛铁矿(主要成分为![]() ,还含有少量
,还含有少量![]() 、
、![]() 、
、![]() 等杂质)制备锂离子电极材料—
等杂质)制备锂离子电极材料—![]() 和
和![]() 的工艺流程如下:
的工艺流程如下:
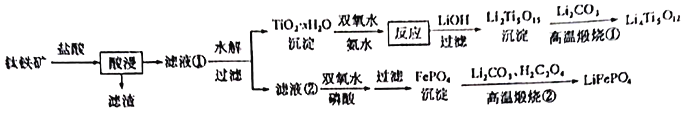
回答下列问题:
(1)![]() 中,Fe元素的化合价为____________。
中,Fe元素的化合价为____________。
(2)“酸浸”后,钛主要以![]() 形式存在,写出
形式存在,写出![]() 水解的的离子方程式_________________。
水解的的离子方程式_________________。
(3)![]() 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
分析高于40℃时![]() 转化率下降的原因_______________。
转化率下降的原因_______________。
(4)![]() 中Ti的化合价为
中Ti的化合价为![]() ,其中过氧键的数目为_____________。
,其中过氧键的数目为_____________。
(5)滤液②中加入双氧水和磷酸,反应生成![]() 的离子方程式为____________;若测得Fe3+沉淀完全后,溶液中
的离子方程式为____________;若测得Fe3+沉淀完全后,溶液中![]() 为
为![]() ,则常温下溶液的pH=______________。(已知
,则常温下溶液的pH=______________。(已知![]() 的
的![]() )
)
(6)从滤液②中得到![]() 沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________。
沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________。
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
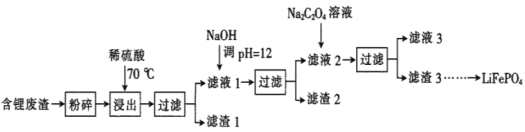
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。