题目内容
【题目】SO2是我国大部分地区雾霾天气产生的主要原因之一。加大SO2的处理力度,是治理环境污染的当务之急。SO2主要来自于汽车尾气、燃煤烟气、硫酸工业尾气、冶金工业烟气等。
(1)“催化转换器”能将汽车尾气中CO与NO转化成可参与大气生态环境循环的无毒气体,并促进烃类充分燃烧及SO2的转化,但也在一定程度上提高了空气的酸度。“催化转换器”提高空气酸度的原因是_____________________________。
(2)用氨水将燃煤烟气中的SO2转化成NH4HSO3。该法是利用了SO2________(填选项字母编号)
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物性质
(3)用生物质热解气(主要成分CO、CH4、H2)将燃煤烟气中SO2在高温下还原成单质硫。主要发生了下列反应:
2H2(g) +SO2(g)= S(g) + 2H2O(g) △H1 = + 90.4kJmol-1
2CO(g) +O2(g)= 2CO2(g) △H2 = - 566.0kJmol-1
S(g) +O2(g)= SO2(g) △H3 = - 574.0kJmol-1
试写出CO将SO2还原成S(g)的热化学方程式__________________________。
(4)将硫酸工业尾气中的SO2转化成硫酸,同时获得电能。装置如图所示(电极均为惰性材料):
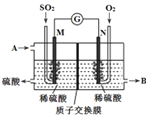
①溶液中的H+移向_______。(填“M”或“N”)
②M极发生的电极反应式为________________。
③写出A、B所代表的物质的化学式:
A_______、B ________。
(5)利用硫酸钠溶液吸收冶金工业烟气中SO2,再用惰性电极电解,能获得所需的产品,装置如图所示。
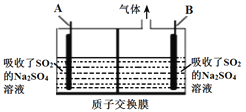
①若电解后A极区得到硫酸,则B电极反应式为________________________。
②若电解后A极区析出硫磺,则电解反应的化学方程式为________________。
【答案】 催化转换器将SO2转化成了SO3,在空气中生成了H2SO4液滴 D 2CO(g) +SO2(g)= S(g) + 2CO2(g) △H= + 8.0kJmol-1 N SO2 + 2H2O -2e- =SO42- + 4H+ H2O H2O 2H+ + 2e- = H2↑ SO2 ![]() S + O2↑
S + O2↑
【解析】(1)由于“催化转化器”促进了SO2的转化,生成的SO3增多,SO3+H2O=H2SO4,提高了空气的酸度,故答案为:催化转换器将SO2转化成了SO3,在空气中生成了H2SO4液滴;
(2)氨水吸收燃煤烟气中的SO2转化为NH4HSO3,反应离子方程式为:NH3+SO2+H2O=NH4++HSO3-,该反应体现了二氧化硫酸性氧化物的性质,故答案为: D;
(3)①2H2(g) +SO2(g)= S(g) + 2H2O(g)△H1 = + 90.4kJ/mol,②2CO(g) +O2(g)= 2CO2(g) △H2 =-566.0kJ/mol,③S(g) +O2(g)= SO2(g) △H3 =-574.0kJ/mol
根据盖斯定律,将②-③得2CO(g) +SO2(g)= S(g) + 2CO2(g) △H=(-566.0kJ/mol)-(-574.0kJ/mol)=+ 8.0kJmol-1,故答案为:2CO(g) +SO2(g)= S(g) + 2CO2(g) △H= + 8.0kJmol-1;
(4)①硫酸工业尾气中的SO2经分离后,可用于制备硫酸,是二氧化硫失电子得到硫酸根的氧化反应过程,该反应过程是原电池负极发生的反应,所以M是负极,则N为正极。在原电池中,阳离子向正极移动,故答案为:N;
②该电极上SO2被氧化生成SO42-,负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,故答案为:SO2+2H2O-2e-=SO42-+4H+;
③根据负极的电极反应可知,A为水;正极上的电极反应式为O2 + 4e-- + 4H+ == 2H2O,因此 B为水,故答案为:H2O;H2O;
(5)①若电解后A极区得到硫酸,则发生二氧化硫被氧化为硫酸的反应,因此A为阳极,则B为阴极,电极反应式为2H+ + 2e- = H2↑,故答案为:2H+ + 2e- = H2↑;
②若电解后A极区析出硫磺,则发生二氧化硫被还原为硫的反应,则B为阳极,发生氧化反应,水中氢氧根离子失去电子生成氧气,电解反应的化学方程式为SO2 ![]() S + O2↑,故答案为:SO2
S + O2↑,故答案为:SO2 ![]() S + O2↑。
S + O2↑。

 阅读快车系列答案
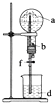
阅读快车系列答案【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d,呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
a(干燥气体) | b(液体) |
| |
A | NO | 水 | |
B | CO2 | 4molL﹣1NaOH溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 热的浓的NaOH溶液 |
A.A
B.B
C.C
D.D