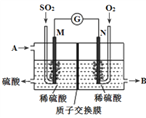
题目内容
【题目】硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
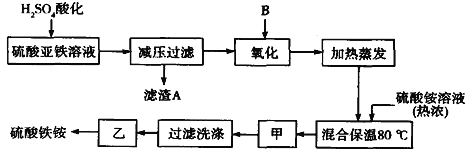
请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是_________,滤渣A的主要成分是________。
(2)下列物质中最适合的氧化剂B是______(填字母);反应的离子方程式___________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲名称分别是:甲______________,乙为常温晾干。
(4)上述流程中,氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,所加试剂为__(写化学式),能否用酸性的KMnO4溶液?_________填“能”或“否”)理由是:_______。(可用语言或方程式说明)
(5)称取14.00 g样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba(NO3)2溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________。
【答案】 增大溶液中SO![]() 浓度,将Ca2+转化为沉淀(同时抑制Fe2+水解或抑制Fe2+、Fe3+水解) CaSO4 b H2O2+2Fe2++2H+= 2Fe3++ 2H2O 冷却结晶 K3[Fe(CN)6] 否 因为H2O2和Fe2+均能使酸性的KMnO4溶液褪色 Fe2(SO4) 3·2(NH4) 2SO4·2H2O
浓度,将Ca2+转化为沉淀(同时抑制Fe2+水解或抑制Fe2+、Fe3+水解) CaSO4 b H2O2+2Fe2++2H+= 2Fe3++ 2H2O 冷却结晶 K3[Fe(CN)6] 否 因为H2O2和Fe2+均能使酸性的KMnO4溶液褪色 Fe2(SO4) 3·2(NH4) 2SO4·2H2O
【解析】原料中加入硫酸酸化,可生成硫酸钙沉淀,减压过滤后加入B氧化可生成硫酸铁,加入硫酸铵,在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤、洗涤,最后经常温晾晒可到纯净的硫酸铁铵,(1)硫酸亚铁溶液加H2SO4酸化的主要目的是增大溶液中SO![]() 浓度,将Ca2+转化为沉淀,同时抑制Fe2+水解或抑制Fe2+、Fe3+水解;滤渣A的主要成分是CaSO4;(2)减压过滤后加入B氧化可生成硫酸铁,为了不引入新的杂质离子, NaClO、KMnO4、K2Cr2O7都不选,选择H2O2,反应生成水,不会产生新的杂质,答案选b;反应的离子方程式为:H2O2+2Fe2++2H+= 2Fe3++ 2H2O;(3)在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,温度不能过高,防止分解,故答案为冷却结晶;(4)检验Fe2+应该使用黄色的铁氰化钾K3[Fe(CN)6]溶液;Fe2+与铁氰根离子反应生成带有特征蓝色的铁氰化亚铁沉淀:3 Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;不能用酸性的KMnO4溶液,因为过氧化氢和Fe2+均能使酸性高锰酸钾溶液褪色;(5)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀,应为Fe(OH)3,n(Fe(OH)3)=
浓度,将Ca2+转化为沉淀,同时抑制Fe2+水解或抑制Fe2+、Fe3+水解;滤渣A的主要成分是CaSO4;(2)减压过滤后加入B氧化可生成硫酸铁,为了不引入新的杂质离子, NaClO、KMnO4、K2Cr2O7都不选,选择H2O2,反应生成水,不会产生新的杂质,答案选b;反应的离子方程式为:H2O2+2Fe2++2H+= 2Fe3++ 2H2O;(3)在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,温度不能过高,防止分解,故答案为冷却结晶;(4)检验Fe2+应该使用黄色的铁氰化钾K3[Fe(CN)6]溶液;Fe2+与铁氰根离子反应生成带有特征蓝色的铁氰化亚铁沉淀:3 Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;不能用酸性的KMnO4溶液,因为过氧化氢和Fe2+均能使酸性高锰酸钾溶液褪色;(5)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀,应为Fe(OH)3,n(Fe(OH)3)=![]() =0.02mol,向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,所以14.00g样品中含有Fe2(SO4)3 0.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,n(H2O)=
=0.02mol,向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,所以14.00g样品中含有Fe2(SO4)3 0.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,n(H2O)=![]() =0.04mol,n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,所以化学式为Fe2(SO4)32(NH4)2SO42H2O。
=0.04mol,n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,所以化学式为Fe2(SO4)32(NH4)2SO42H2O。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】用0.001mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液,回答下列 问题:
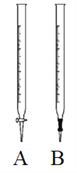
(1)酸性高锰酸钾溶液应该装在下图__________滴定管中。
(2)请写出该反应的离子方程式:____________________。
(3)用0.001mol/L的酸性高锰酸钾溶液滴定草酸溶液,滴定终点的判断依据是:_________________。
(4)己知滴定V1ml待测液消耗标准液实验数据如下表
实验次数 | 始读数(ml) | 末读数(ml) | 消耗体积 |
1 | 0.10 | 19.20 | 19.10 |
2 | 1.85 | 20.75 | 18.90 |
3 | 0.00 | 24.06 | 24.06 |
则待测液的浓度为:_______________
(5)滴定结束时,俯视刻度线读取高锰酸钾溶液的体积,会导致测定结果_________(填“偏大”“偏小”或“不影响”)
(6)己知NaHC2O4溶液中草酸氢根离子的电离大于水解,则溶液中各离子的浓度按由大到小的顺序排列的是:_________________________。
【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用试剂和分离方法能达到实验目的是
混合物 | 试剂 | 分离方法 | |
A | 乙烯(二氧化硫) | 溴水 | 洗气 |
B | 乙烷(乙烯) | 氢气 | 加热 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
D | 溴苯(溴) | NaOH溶液 | 分液 |
A. A B. B C. C D. D