题目内容
【题目】铬铁合金作为钢的添加料生产多种具有高强度、耐高温、耐腐蚀等优良性能的特种钢,这类特种钢中含有碳、硅、氧、氮、磷等元素。
(1)基态Cr原子的价电子排布式为___。
(2)C、N、O三种元素的第一电离能由大到小的顺序为___。
(3)PO43-的空间构型为___,中心原子的杂化方式为___。
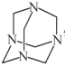
(4)无水CrCl3和氨分子作用能形成某种配合物,该配合物的组成相当于CrCl3·6NH3。已知:若加入AgNO3溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入NaOH溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构式__,1mol该配合物中含有σ键的数目为__。
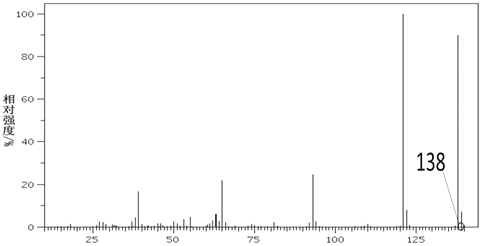
(5)铁和氮形成一种晶体,晶胞结构如图所示,则该晶体的化学式为___,若该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的体积是__cm3。
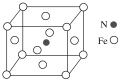
【答案】3d54s1 N>O>C 正四面体 sp3 [Cr(NH3)6]Cl3 24NA Fe4N ![]()
【解析】
根据题意可知,本题考查原子电子排布、元素电离能、粒子空间构型、中心原子杂化方式等,运用电子排布规则、元素电离能规律、VSEPR理论分析。
(1)基态Cr原子核外有24个电子,电子排布式为[Ar] 3d54s1,故价电子排布式为3d54s1;
故答案为:3d54s1;
(2)同周期主族元素从左到右第一电离能呈增大趋势,但由于N的2p能级上电子半充满,为较稳定结构,故其第一电离能大于O的第一电离能,故第一电离能:N>O>C;
故答案为:N>O>C;
(3)PO43-中P无孤电子对,形成的σ键数目为4个,空间构型为正四面体形,中心原子P的杂化方式为sp3杂化;
故答案为:正四面体形;sp3杂化;
(4) 加入AgNO3溶液,能将所有氯沉淀,说明Cl-为外界,加入NaOH溶液并加热,无刺激性气体产生,说明NH3在内界,故该配合物的结构式为[Cr(NH3)6]Cl3,该配合物中Cr与6个NH3之间的配位键均为σ键,NH3中N-H键为σ键,故1mol该配合物中含有σ键的数目为24NA;
故答案为:[Cr(NH3)6]Cl3;24NA;
(5)该晶胞中Fe位于顶点和面心,Fe原子个数为![]() ,N位于体心,个数为1,故该晶体的化学式为Fe4N。该晶胞质量为
,N位于体心,个数为1,故该晶体的化学式为Fe4N。该晶胞质量为![]() =
=![]() g,故该晶胞的体积为
g,故该晶胞的体积为![]() g
g ![]() g
g![]() cm3=
cm3=![]() cm3;
cm3;
故答案为:Fe4N;![]() 。
。

 阅读快车系列答案
阅读快车系列答案