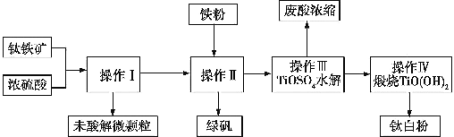
题目内容
【题目】硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是

A.CO、SO2、SO3均是酸性氧化物
B.工业上利用Cl2和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
【答案】C
【解析】
A.SO2、SO3均是酸性氧化物,CO是不成盐氧化物, A错误;
B.工业上利用Cl2和石灰乳反应来制取漂白粉,B错误;
C.除去与水反应,图示转化反应中均有元素化合价的升降,故反应均为氧化还原反应,C正确;
D.用CO与氢气反应合成CH3OH,反应物完全转化为生成物,原子利用率为100%,甲醇与氧气在催化剂存在时发生反应HCHO和水,所以该步反应中原子利用率不为100%,D错误;
故答案选C。

 天天练口算系列答案
天天练口算系列答案【题目】下列实验能达到实验目的的是( )
实验目的 | 实验操作 | |
A | 比较S和Si的非金属性强弱 | 向Na2SiO3溶液中通入SO2产生白色沉淀 |
B | 除去NaHCO3溶液中的杂质Na2CO3 | 向混合液中通入足量的CO2气体 |
C | 检验某盐是否为铵盐 | 试样 |
D | 验证H2O2和Fe3+的氧化性 强弱 | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
A. A B. B C. C D. D
【题目】溴苯是一种常见的化工原料。查阅资料知:苯和液溴在溴化铁(FeBr3)存在的条件下可发生反应生成溴苯,此反应为放热反应。实验室合成溴苯的装置示意图及有关数据如下。先向A中加入16.0mL的无水苯和5.0mL液溴,再将混合液慢慢滴入反应器B中。请回答下列问题:
苯 | 溴 | 溴苯 | |
相对分子质量 | 78 | 160 | 157 |
颜色状态 | 无色液体 | 深红棕色液体 | 无色液体 |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中的溶解性 | 难溶 | 微溶 | 难溶 |
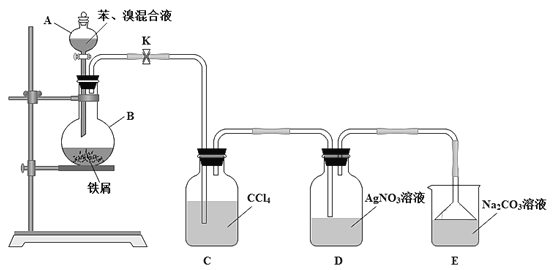
(1)仪器A的名称为____。
(2)反应器B中发生的主要有机反应的化学方程式是___。
(3)下列关于该实验操作或叙述错误的是___(填字母序号)。
a.向反应器B中滴加苯和溴的混合液前需先关闭K
b.实验中装置C中的液体逐渐变为浅红色
c.实验中装置D中的导管口附近有白雾产生,溶液中产生淡黄色的沉淀,根据该现象说明苯和液溴发生的反应为加成反应
d.装置D中的导管不能插入液面以下和装置E中导管末端连接倒扣着的漏斗都是为了防倒吸
e.溴苯不能与AgNO3溶液反应产生淡黄色沉淀
(4)实验完毕待冷却后,经过下列步骤对溴苯进行分离提纯:
①向B中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。用NaOH溶液洗涤的作用是___;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(5)经过上述分离操作后,粗溴苯中还含有的主要杂质为__,要进一步提纯,下列操作中必须的是___。
a.萃取 b.蒸馏 c.重结晶 d.过滤 e.分液
(6)若经过上述分离提纯的操作,经进一步精制得到6.2mL的溴苯,则该实验中溴苯的产率是___(计算结果保留三位有效数字)。
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将铜粉加入1.0mol/LFe2(SO4)3溶液中 | 溶液变为蓝色 | 金属铁比铜活泼 |
B | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝不滴落下来 | 氧化铝的熔点高于铝的熔点 |
C | 常温下,用pH计测0.1mol/LNaX溶液和0.1mol/LNa2CO3溶液的pH | 前者小于后者 | 酸性:HX>H2CO3 |
D | 向10%的蔗糖溶液中加入少量稀硫酸,水浴加热一段时间,再加入银氨溶液 | 未出现光亮银镜 | 蔗糖未发生水解 |
A. A B. B C. C D. D