题目内容
【题目】某电池的工作原理如图所示,总反应为:Zn+H2O2+2H+=Zn2++2H2O,下列说法正确的是( )
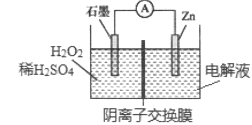
A.石墨为电池的负极
B.电池工作时H2O2被氧化
C.Zn极的电解液为酸性电解液,增加导电性
D.电子由Zn电极经外电路流向石墨电极
【答案】D
【解析】
A.根据总反应为Zn+H2O2+2H+=Zn2++2H2O可知,锌被氧化,故锌是负极,石墨为电池的正极,A错误;
B.根据总反应为Zn+H2O2+2H+=Zn2++2H2O可知,电池工作时H2O2被还原,B错误;
C.若Zn极的电解液为酸性电解液,则锌直接与电解液反应不需要发生电子转移,这样就不能形成原电池了,故Zn电极的电解液不能是酸性电解液,C错误;
D.电子由负极即Zn电极经外电路流向正极即石墨电极,D正确;
故答案为:D。

【题目】已知在温度低于570 ℃时,还原铁粉与水蒸气反应的产物是FeO,高于570 ℃时,生成Fe3O4。老师用上图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。
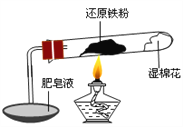
甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
根据上述实验,下列说法不正确的是
A.试管内的固体一定含有铁粉
B.试管内的固体一定不含有Fe3O4
C.不能确定试管内的固体一定含有FeO
D.可通过将试管内固体彻底还原,分析其质量减小的方法来确定是否含有Fe3O4
【题目】温度为T时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]()
![]() ,反应
,反应![]() 经过一段时间后达到平衡。反应过程中测定的部分数据见表:下列说法正确的是
经过一段时间后达到平衡。反应过程中测定的部分数据见表:下列说法正确的是![]()
| 0 | 50 | 150 | 250 | 350 |
| 0 |
|
|
|
|
A.反应在前50s的平均速率![]()
![]()
B.保持其他条件不变,升高温度,平衡时![]()
![]() ,则反应的
,则反应的![]()
C.相同温度下,起始时向容器中充入![]() mol
mol![]() 、
、![]() mol
mol![]() 和
和![]() mol
mol![]() ,反应达到平衡前
,反应达到平衡前![]() 正
正![]() 逆
逆![]()
D.相同温度下,起始时向容器中充入![]() mol
mol![]() 和
和![]() mol
mol![]() ,达到平衡时,
,达到平衡时,![]() 的转化率小于
的转化率小于![]()
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
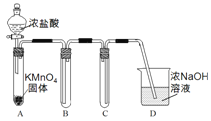
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。