题目内容
19.常温下,pH=8~9的Na2SO3溶液中存在:SO32-+H2O=HSO3-+OH-,下列说法正确的是( )| A. | c(SO32-)>c(OH-)>c(HSO3-) | B. | c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+) | ||
| C. | 加入少量NaOH固体,Kw增大 | D. | 加入稀盐酸,c(HSO3-)减小 |
分析 Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-,HSO3-+H2O=H2SO3+OH-,
A.存在两步水解,而且水解程度较小;
B.根据质子守恒分析;
C.Kw只与温度有关;
D.加入盐酸,水解平衡正移.
解答 解:Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-,HSO3-+H2O=H2SO3+OH-,
A.存在两步水解,而且水解程度较小,所以c(SO32-)最大,由于两步水解均能生成氢氧根离子,则c(OH-)>c(HSO3-),所以c(SO32-)>c(OH-)>c(HSO3-),故A正确;
B.盐溶液中水电离的氢离子与氢氧根离子相同,而氢离子有多种存在形式,则c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+),故B正确;
C.Kw只与温度有关,加入NaOH,Kw不变,故C错误;
D.加入盐酸,SO32-+H2O?HSO3-+OH-平衡正移,则c(HSO3-)增大,故D错误.
故选AB.
点评 本题考查了水解平衡原理、离子浓度大小比较,题目难度不大,注意把握影响盐的水解平衡移动的因素.

练习册系列答案
相关题目
5.将SO2和SO3混合气体通入过量的BaCl2溶液中,下列说法中正确的是( )
| A. | 两种气体被完全吸收,并生成BaSO4沉淀 | |
| B. | 两种气体被完全吸收,生成BaSO3和BaSO4沉淀 | |
| C. | 两种气体均不能被吸收,没有沉淀生成 | |
| D. | 只有一种气体被吸收,生成BaSO4沉淀 |
7.不能鉴别AgNO3、BaCl2、K2SO3和Mg(NO3)2四种溶液(不考虑它们间的相互反应)的试剂组是( )
| A. | 盐酸、硫酸 | B. | 氨水、氢氧化钠溶液 | ||
| C. | 氯化钠溶液、硫酸 | D. | 盐酸、氢氧化钠溶液 |
14.下列事实能用电化学理论解释的是( )
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 铝片不用特殊方法保存 | |
| C. | 纯锌与稀硫酸反应时,滴入少量浓H2SO4溶液后速率加快 | |
| D. | 镀锌铁不如镀锡铁耐用 |
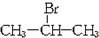 ,且烃A的结构简式为
,且烃A的结构简式为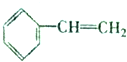 ,其在不同条件下能发生下图所示的一系列变化.
,其在不同条件下能发生下图所示的一系列变化.
 ,D
,D ,E
,E ,H
,H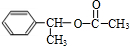 .
. +NaBr.
+NaBr. .
.