题目内容
9.(1)浓度均为0.01mol/L的8种溶液:①HNO3、②H2SO4、③CH3COOH、④Ba(OH)2、⑤NaOH、⑥CH3COONa、⑦KCl、⑧NH4Cl,这些溶液pH由小到大的顺序是④⑤⑥⑦⑧③①②(填编号).
(2)pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,恰好反应生成正盐,混合液pH=8.
①反应生成的正盐的化学式为BnAm.
②该盐中An-离子一定能水解,其水解的离子方程式为An-+H2O?HA(n-1)-+OH-.
分析 (1)先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较PH,再按照溶液的PH由大到小进行排序;
(2)pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合生成正盐,说明酸中氢离子的总物质的量和碱中氢氧根离子的总物质的量相等,其盐溶液呈碱性,说明碱的电离程度大于酸的电离程度,根据化合物中化合价的代数和为0确定其化学式,根据酸碱的相对强弱确定水解的离子.
解答 解:(1)属于碱的为:④Ba(OH)2⑤NaOH,浓度相同时,碱性④>⑤;
水解呈碱性的为:⑥CH3COONa,但水解程度较小,则pH:④>⑤>⑥;
溶液呈中性的为:⑦KCl;
溶液呈酸性的有:①②③⑧,其中①为一元强酸,②为二元强酸,③为弱酸,⑧水解呈酸性,浓度相同时,
溶液的pH:②<①<③<⑧,
综合以上分析可知,溶液的pH由大到小的顺序是为:④⑤⑥⑦⑧③①②,
故答案为:④⑤⑥⑦⑧③①②;
(2)①HnA中A的化合价是-n价,B(OH)m中B的化合价是+m价,根据化合物中化合价的代数和为0知,二者的离子个数之比为n:m,则其化学式为:BnAm,
故答案为:BnAm;
②根据题意知,其正盐溶液呈碱性,说明碱的电离程度大于酸的电离程度,生成的盐是强碱弱酸盐,则An-离子一定能水解,其水解方程式为:An-+H2O?HA(n-1)-+OH-,
故答案为:An-;An-+H2O?HA(n-1)-+OH-.
点评 本题考查了溶液pH大小比较、酸碱混合溶液定性判断,明确“谁强谁显性、谁弱谁水解”即可解答,并结合化合物中化合价的代数和为0进行分析,难度中等.

练习册系列答案
相关题目
17.绿色化学最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物.以下反应最符合这一要求的是( )
| A. | 铜和浓硝酸反应制硝酸铜 | |
| B. | 用铜作催化剂将乙醇氧化为乙醛 | |
| C. | 乙烯聚合为聚乙烯 | |
| D. | 光照条件下甲烷与氯气反应制一氯甲烷 |
14.加热73.5g氯酸钾固体,固体完全分解后得到氧气的物质的量为( )
| A. | 0.9mol | B. | 9mol | C. | 1.8mol | D. | 0.6mol |
1.将标况下的2.24LCO2通入150mL 1mol•L-1NaOH溶液中,溶液中离子浓度由小到大的顺序为 ( )
| A. | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | B. | c(Na+)>c(HCO3-)=c(CO32-)>c(OH-)>c(H+). | ||
| C. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | D. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
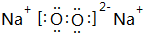 ;
;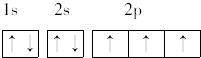 ,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.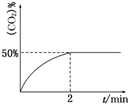 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为: