题目内容
17.绿色化学最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物.以下反应最符合这一要求的是( )| A. | 铜和浓硝酸反应制硝酸铜 | |
| B. | 用铜作催化剂将乙醇氧化为乙醛 | |
| C. | 乙烯聚合为聚乙烯 | |
| D. | 光照条件下甲烷与氯气反应制一氯甲烷 |
分析 绿色化学就是要求环保,无污染;原子经济性是指原料物质中的所有原子完全被利用,全部转入期望的产物中.即原子利用率100%.
解答 解:A、以铜和浓硝酸为原料生产硝酸铜,因有有毒气体二氧化氮生成,故A错误;
B、乙醇催化氧化制乙醛,有机反应大多都是可逆反应,故B错误;
C、乙烯聚合为聚乙烯高分子材料,为加聚反应,原料利用率为100%,故C正确;
D、甲烷与氯气制备一氯甲烷为取代反应,有副产品HCl生成,故D错误;
故选C.
点评 本题考查绿色化学和原子经济性,明确实质是反应物全部反应生成所需的产物,不造成浪费且无污染.

练习册系列答案
相关题目
7.下列物质的制备方法正确的是( )
| A. | 蛋白质水解可制得葡萄糖 | |
| B. | 用硅酸钠溶液与稀盐酸反应可制得硅酸 | |
| C. | 二氧化锰和稀盐酸混合加热可制得氯气 | |
| D. | 将饱和氯化铁溶液加热至沸腾可制得氢氧化铁胶体 |
8.已知甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B.其转化关系如图1所示:
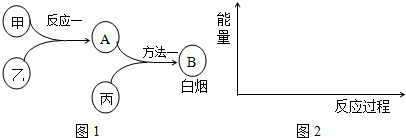
ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期族
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
(2)已知反应一是放热反应,画出能量关系示意图2.
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和增大压强.
(4)方法一的化学方程式是3Cl2+8NH3=N2+6NH4Cl.
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是方法二(填“方
法一”或“方法二”),理由是方法二的原子利用率100%,零排放,符合绿色化学理念.

ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期族
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
| 1 | ||||||||
| 2 | ||||||||
| 3 |
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和增大压强.
(4)方法一的化学方程式是3Cl2+8NH3=N2+6NH4Cl.
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是方法二(填“方
法一”或“方法二”),理由是方法二的原子利用率100%,零排放,符合绿色化学理念.
12.下列关于0.2mol/LNaHCO3溶液的说法正确的是( )
| A. | 溶质电离方程式为NaHCO3═Na++H++CO32- | |
| B. | 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 | |
| C. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
2.下列物质中属于还原性糖,能水解且最终产物为一种物质的是( )
| A. | 蔗糖 | B. | 麦芽糖 | C. | 淀粉 | D. | 纤维素 |
5.已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-98.32kJ/mol,下列表述正确的是( )
| A. | 在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量等于196.64kJ | |
| B. | 在容器中当有2mol SO2和1mol O2发生反应时,放出的热量等于196.64kJ | |
| C. | 在容器中当有4mol SO2和2mol O2发生反应时,反应SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)的反应热为-393.28kJ/mol | |
| D. | 在容器中当有4mol SO2和2mol O2发生反应时,反应SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)的反应热为98.32kJ/mol |
6.下列说法中正确的是( )
| A. | 胶体区别于其它分散系的本质特性是丁达尔效应 | |
| B. | 利用半透膜可除去淀粉溶液中的少量NaCl | |
| C. | Fe(OH)3胶体带正电荷 | |
| D. | 胶体能产生丁达尔效应的原因是胶粒使光线发生了折射 |