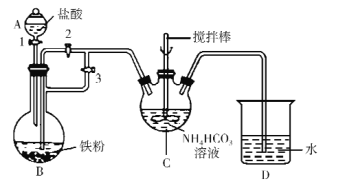
题目内容
【题目】实验室配制100mL 0.2 mol·L-1的Na2CO3溶液,试回答下列问题:
(1)若要实施配制,除天平、烧杯、玻璃棒外,还需的玻璃仪器有________, ________;
(2)配制完毕后,教师指出有三位同学进行了下列某一项错误操作,你认为这三项错误操作中会导致所得溶液浓度偏高的是________(填选项字母)
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度线
(3)通过计算得出可用天平称取Na2CO3固体________g。若用4 mol·L-1的Na2CO3浓溶液配制100 mL 0.2 mol·L-1的稀溶液,应用量筒量取______mL该浓溶液。
【答案】100mL容量瓶 胶头滴管 B 2.1g 5.0mL
【解析】
(1)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(2)分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 进行误差分析;
进行误差分析;
(3)依据m=cVM计算需要固体碳酸钠的质量;
依据稀释前后溶质的物质的量不变计算。
(1)配制一定物质的量浓度溶液的一般步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶和胶头滴管,故还需的仪器有100mL容量瓶、胶头滴管;
(2)A.定容时仰视容量瓶刻度线,导致溶液体积偏大,溶液浓度偏低,故A不选;
B.定容时俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故B选;
C.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度线,导致溶液体积偏大,溶液浓度偏低,故C不选;
故选B。
(3)配制100mL 0.2mol·L-1的Na2CO3溶液,需要溶质Na2CO3的质量=0.2mol·L-1×0.1L×106g·mol-1=2.1g;
若用4mol·L-1的Na2CO3浓溶液配制100mL0.2mol·L-1的稀溶液,设需要浓溶液体积为V,依据稀释前后溶质的物质的量不变得0.2mol·L-1×0.1L=4mol·L-1×V,解得:V=0.005L。即5.0mL。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】用电解法处理含Cr2072-的废水,探究不同因素对含Cr2072-废水处理的影响,结果如表所示(Cr2072-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(S04)3 | 否 | 否 | 否 | ||
是否加入H2S04 | 否 | 加入lmL | 加入lmL | 加入lmL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
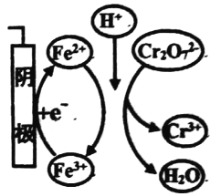
Cr2072-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2072-的机理 |
A. 实验ii与实验i对比,其他条件不变,增加c(H+)有利于Cr2072-的去除
B. 实验iii与实验ii对比,其他条件不变,增加c(Fe3+)有利于Cr2072-的去除
C. 实验iv中循环利用提高了Cr2072-的去除率
D. 若实验iv中去除O.OlmolCr2072-电路中共转移0.06mol电子