题目内容
设反应①Fe(s)+CO2(g) FeO(s)+CO(g)△H=Q1的平衡常数为K1,
FeO(s)+CO(g)△H=Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
| 温度(T) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应;
(2)现有反应③H2(g)+CO2(g)
 CO(g)+H2O(g)△H=Q3
CO(g)+H2O(g)△H=Q3①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3=_____________;
(1)吸热
(2)①K3=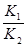 吸DE②Q3=Q1―Q2
吸DE②Q3=Q1―Q2
解析试题分析:
(1)对于反应①来说,升高温度其平衡常数增大,说明平衡正向移动,依据平衡移动原理:如果改变影响化学平衡的一个条件,那么平衡就向着能够减弱这种改变的方向移动,可知:正向是吸热的方向。
(2)反应①减去反应②就可以得到反应③:H2(g)+CO2(g) CO(g)+H2O(g)△H=Q3;因此反应应③的K3=
CO(g)+H2O(g)△H=Q3;因此反应应③的K3=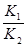 ;从表中的数据可知,随着温度的升高,K3的值是逐渐升高的,因此该反应是吸热反应;缩小容器体积,平衡不移动;降低温度,平衡逆向移动;使用合适的催化剂,平衡不移动;设法减少CO的量,减小了生成物的浓度,平衡右移;升高温度,平衡向着吸热的方向移动,因此选DE②Q3=Q1―Q2
;从表中的数据可知,随着温度的升高,K3的值是逐渐升高的,因此该反应是吸热反应;缩小容器体积,平衡不移动;降低温度,平衡逆向移动;使用合适的催化剂,平衡不移动;设法减少CO的量,减小了生成物的浓度,平衡右移;升高温度,平衡向着吸热的方向移动,因此选DE②Q3=Q1―Q2
考点:考查反应热。

 小学课时特训系列答案
小学课时特训系列答案在体积固定的密闭容器中,进行如下化学反应:N2O4(g) 2NO2(g),其化学平衡常数K和温度t的关系如下表:
2NO2(g),其化学平衡常数K和温度t的关系如下表:
| t /℃ | 80 | 100 | 120 |
| K | 1.80 | 2.76 | 3.45 |
请回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)判断该反应达到化学平衡状态的依据是 。
A.容器内混合气体密度不变
B.混合气体中c(NO2)不变
C.0.5mol N2O4分解的同时有1 mol NO2生成
(4)在80℃时,将2.80molN2O4气体充入2L固定容积的密闭容器中,一段时间后对该容器内的物质进行分析,得到如下数据:
 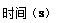 | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 2.80 | A | 2.00 | c | d | 1.60 |
| n(NO2) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
①b的值为 ;
②N2O4的平衡转化率为 ;
③20s~40s内用N2O4表示的平均反应速率υ(N2O4)= 。
(7分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一恒容密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,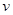 (H2)= ;10min时,改变的外界条件可能是 .
(H2)= ;10min时,改变的外界条件可能是 .
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象
(3)反应③中△H3= .800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系式是 (填代号).
a.v(正)>v(逆) b.v(正)<v(逆)
c.v(正)=v(逆) d.无法判断.
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g)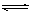 CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
| 容器编号 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| ① | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4 |
| ② | 650 | 2 | 4 | | | t1 | Q1 |
| ③ | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 |
(2)容器③中反应达平衡时,CO的转化率为____________。
(3)容器①中反应达平衡这段时间,化学反应速率
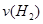 =__________。
=__________。(4)该反应的正反应为_______(填“吸热”或“放热”)反应,理由是____________。
(5)下列叙述正确的是____________(填字母序号)。
a.平衡时,容器①和容器②中CO2的体积分数相等
b.反应达平衡状态时,Q2>Q1>32.8kJ
c.达到平衡的时间:t2>t1>2.5min
d.该反应的热化学方程式可表示为:CO(g)+H2O(g)
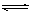 CO2(g)+H2(g) △H= -41kJ/mol
CO2(g)+H2(g) △H= -41kJ/mol 在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应应:
A(g) B(g)+C(g) △H ="+85.1" kJ· mol-1
B(g)+C(g) △H ="+85.1" kJ· mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为 ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
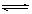 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。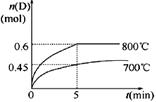
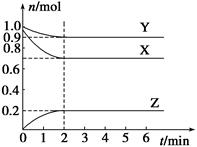
 CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol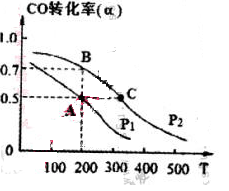
 2SO3(g) △H=-196.6 KJ·mol-1)
2SO3(g) △H=-196.6 KJ·mol-1)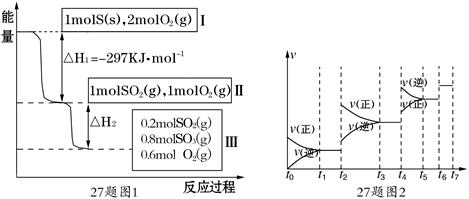
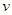 与时间t的关系如图2所示,若不改变SO2 (g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 .
与时间t的关系如图2所示,若不改变SO2 (g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 .