题目内容
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g) CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
| 容器编号 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| ① | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4 |
| ② | 650 | 2 | 4 | | | t1 | Q1 |
| ③ | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 |
(2)容器③中反应达平衡时,CO的转化率为____________。
(3)容器①中反应达平衡这段时间,化学反应速率
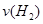 =__________。
=__________。(4)该反应的正反应为_______(填“吸热”或“放热”)反应,理由是____________。
(5)下列叙述正确的是____________(填字母序号)。
a.平衡时,容器①和容器②中CO2的体积分数相等
b.反应达平衡状态时,Q2>Q1>32.8kJ
c.达到平衡的时间:t2>t1>2.5min
d.该反应的热化学方程式可表示为:CO(g)+H2O(g)
 CO2(g)+H2(g) △H= -41kJ/mol
CO2(g)+H2(g) △H= -41kJ/mol
(1)0.17(2)80℅(3)0.04mol/L(4)吸热 升高温度,反应物的转化率增大。(5)a
解析试题分析:(1)化学平衡常数只跟反应温度有关,而与投料方式无关,对于①②化学平衡常数一样。K={C(CO2)·C(H2)}∕{C(CO)·C(H2O)}=(0.2×0.2) ∕{(0. 5-0.2) ×(1-0.2)}=1∕6=0.17.(2)对于容器③达到化学平衡时二氧化碳、氢气的平衡浓度为0.8mol∕L,则消耗的CO、 H2O的浓度也是0.8mol∕L。所以C(CO)(平衡)=(1-0.8)mol∕L=0.2 mol∕L;C(H2O)(平衡)=(2-0.8)mol∕L=1.2 mol∕L。 CO的转化率为:(0.8∕1)×100℅=80℅。(3)容器①中反应达平衡这段时间,化学反应速率V(H2)=ΔC(H2) ∕Δt={(0.4-0) mol∕2L}∕5min=0.04 mol∕(L·min) (4) 容器②假设CO转化浓度为X,K={C(CO2)·C(H2)}∕{C(CO)·C(H2O)}=X2 ∕{(1-X) ×(2-X)} =1∕6.解得X=0.4 mol∕L.所以CO转化率为:(0.4∕1)×100℅=40℅。容器②③只是温度不同,起始投料相同,但CO的转化率前者是40℅,后者是80℅。可见反应物的转化率增大。根据勒夏特列原理可知升高温度化学平衡向吸热方向移动。故正反应是吸热反应。(5) a.容器①和容器②中投料比例相同,反应又是在相同温度下进行,所以反应物的转化率相同,产物的含量即体积分数相同,正确。b.该反应是气体体积相等的可逆反应。改变压强平衡不移动。由于容器②的物质的量是①的2倍,所以能量转化也是①的2倍。即Q1=32.8kJ。容器③与②比较:③温度高升。升高温度化学平衡向正反应方向移动。转化时能量变化比②多。达平衡状态时,Q2>Q1所以反应达平衡状态时,Q2>Q1=32.8kJ。错误。c.在其它条件不变的情况下,增大反应物的浓度,化学反应速率越快;升高温度,化学反应速率越快,达到平衡所需时间就越短。所以达到平衡的时间:t2<t1<2.5min。错误。d.该反应的正反应是吸热反应。所以其热化学方程式应表示为:CO(g)+H2O(g) CO2(g)+H2(g) △H= +41kJ/mol。错误。
CO2(g)+H2(g) △H= +41kJ/mol。错误。
考点:考查可逆反应的化学平衡常数、反应物的转化率、反应速率等问题的知识。

工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)  CH3OH(g)+Q
CH3OH(g)+Q
(1)能判断反应达到平衡状态的依据是(填字母序号,下同)________。
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应Q________(填“>”、“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________。
(3)要提高CO的转化率,可以采取的措施是________。
a.升温;b.加入催化剂;c.增加CO的浓度;d.加入H2加压;e.加入惰性气体加压;f.分离出甲醇
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:___________________________________________________。
设反应①Fe(s)+CO2(g) FeO(s)+CO(g)△H=Q1的平衡常数为K1,
FeO(s)+CO(g)△H=Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
| 温度(T) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应;
(2)现有反应③H2(g)+CO2(g)
 CO(g)+H2O(g)△H=Q3
CO(g)+H2O(g)△H=Q3①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3=_____________;
在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。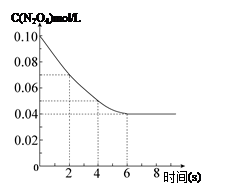
|
(3)在温度为298K时,达到平衡时四氧化二氮的转化率α1等于 。化学平衡常数为 。
(4)若在7s时向该密闭容器中再充入0.10 mol N2O4气体,此时平衡向 方向移动(填“正”或“逆”);再次达平衡时,总计0.20 mol N2O4的转化率为α2,正确的是 ( )
A.α2<α1 B.α2>α1 C.α2=α1 D.无法判断。
(5)下表是不同温度下测定的该反应的化学平衡常数。
| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
据此判断该反应正反应是 反应(填“吸热”或“放热”)
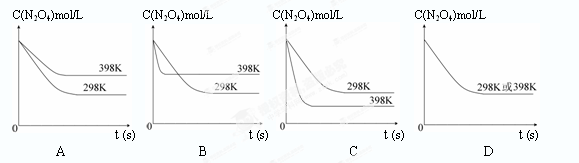
(6)若其他条件不变,反应在398K条件下进行并达到平衡,此温度下N2O4的浓度随时间变化的曲线(以298K条件下进行并达到平衡的曲线作为参照)正确的是 ( )
用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断: 段化学反应速率最快, 段收集的二氧化碳最多。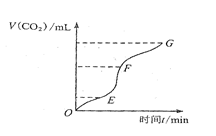
(2)为了减缓上述化学反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
| A.蒸馏水 | B.NaCl固体 | C.NaCl溶液 | D.浓盐酸 |
已知A(g)+B(g) 2 C(g)反应的平衡常数和温度的关系如下:
2 C(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
回答下列问题:
(1) 该反应的平衡常数表达式K=______,△H_____0(填“<”“>”“=”);
(2) 容积固定,判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.气体的密度不随时间改变 b. c(A)不随时间改变
c.混合气体平均相对分子质量不随时间改变 d. 压强不随时间改变
(3)1200℃时反应2C(g)
 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。(4)830℃时,向一个10.00 L的密闭容器中充入0.40mol的A和1.60mol的B,如果反应初始2s内生成C的物质的量为0.40mol,则2s内A的平均反应速率v(A)= ____mol·L-1·s-1; 2s时c(B)= ____ mol·L-1; 2s时A的转化率为____;2s时C的体积分数为____。
 Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。
Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。
 xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
 、
、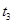 、
、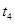 时刻体系中分别是什么条件发生了变化?
时刻体系中分别是什么条件发生了变化?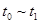 B.
B.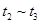 C.
C.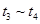 D.
D.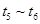
 Si (s)+ 4HCl(g) -236kJ
Si (s)+ 4HCl(g) -236kJ