题目内容
在体积固定的密闭容器中,进行如下化学反应:N2O4(g) 2NO2(g),其化学平衡常数K和温度t的关系如下表:
2NO2(g),其化学平衡常数K和温度t的关系如下表:
| t /℃ | 80 | 100 | 120 |
| K | 1.80 | 2.76 | 3.45 |
请回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)判断该反应达到化学平衡状态的依据是 。
A.容器内混合气体密度不变
B.混合气体中c(NO2)不变
C.0.5mol N2O4分解的同时有1 mol NO2生成
(4)在80℃时,将2.80molN2O4气体充入2L固定容积的密闭容器中,一段时间后对该容器内的物质进行分析,得到如下数据:
  | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 2.80 | A | 2.00 | c | d | 1.60 |
| n(NO2) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
①b的值为 ;
②N2O4的平衡转化率为 ;
③20s~40s内用N2O4表示的平均反应速率υ(N2O4)= 。
(1)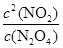 (1分) (2) 吸热(2分) (3) B (2分)
(1分) (2) 吸热(2分) (3) B (2分)
(4)①1.60 (2分) ②42.9% 或0.429(2分) ③0.008 mol·L-1·S-1(2分)
解析试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数表达式K=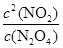 。
。
(2)根据表中数据可知,随着温度的升高,平衡常数逐渐增大。这说明升高温度平衡向正反应方向移动,因此正方应是吸热反应。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。A、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终是不变,所以容器内混合气体密度不变不能说明反应达到平衡状态,A不正确;B、混合气体中c(NO2)不变可以说明反应得到平衡状态,B正确;C、根据反应式可知,0.5mol N2O4分解的同时一定有1 mol NO2生成,所以不能说明反应达到平衡状态,C不正确,答案选B。
(4)①根据表中数据可知,反应进行到20s时NO2的物质的量是0.96mol所以消耗N2O4的物质的量是0.96mol÷2=0.48mol,则剩余N2O4的物质的量=2.80mol-0.48mol=2.32mol,即A=2.32mol。从20s进行到40s消耗N2O4的物质的量=2.32mol-2.00mol=0.32mol,所以生成NO2的物质的量=0.32mol×2=0.64mol,则b=0.96mol+0.64mol=1.60mol,即b=1.60mol。
②根据表中数据可知,反应进行到80s时NO2的物质的量不再发生变化,说明反应达到平衡状态,此时消耗N2O4的物质的量=2.40mol÷2=1.20mol,所以N2O4的转化率=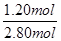 ×100%=42.9%。
×100%=42.9%。
③20s~40s内消耗N2O4的浓度=0.32mol÷2L=0.16mol/L,所以用N2O4表示的平均反应速率υ(N2O4)=0.16mol/L÷20s=0.008 mol·L-1·S-1。
考点:考查平衡常数表达式、反应热和平衡状态判断以及反应速率、转化率的有关计算

甲醇汽油是由10%一25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标。甲醇是一种可再生能源,具有广泛的开发和应用前景。
Ⅰ、工业上合成甲醇一般采用下列反应:CO(g)+2 H2(g) CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol,
下表是该反应在不同温度下的化学平衡常数(K):
| 温度/0C | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
(1)由表中数据判断△H a 0(填“>”、“=”或“<”)。
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)="0.5" mol·L-1,则此时的温度为 0C。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 浓度mol/L 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
①反应从2 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2 mol H2,发生反应CO(g)+2 H2(g)
 CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则w1 w2(填序号)。
A.大于 B.小于 C.等于 D.以上都有可能
Ⅱ、甲醇在化学电源方面也有着重要应用。写出以甲醇为燃料,氢氧化钠溶液为电解质溶液的原电池中负极的电极反应式: 。
(1)已知工业上生产H2的过程中有如下反应: CO (g) + H2O (g) CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
①恒容增大H2O (g)的物质的量,则CO的转化率 (填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是 (填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
| 浓度 物质 | CO | H2O | CO2 | H2 |
| 起始浓度/(mol·L-1) | 2.0 | x | 0 | 0 |
| 平衡浓度/(mol·L-1) | 0.4 | 6.4 | 1.6 | 1.6 |
则上表中x=________________,该温度下平衡常数K的数值是____________。
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
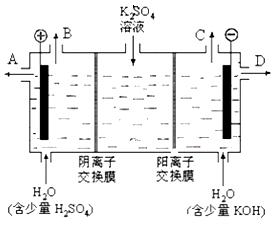
①该电解槽的阳极反应式为 。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)_______导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 ____________________________________。
铁及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-→Fe3O4↓+S4O32-+2H2O
①上述离子方程式中x=________;
②每生成1 mol Fe3O4,反应转移的电子为________mol;
(2)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为 。
高炉炼铁过程中发生的主要反应为: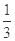 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g) 
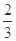 Fe(s)+CO2(g)+Q
Fe(s)+CO2(g)+Q
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(3)该反应的平衡常数表达式K=_ ;Q 0(填“>”、“<”或“=”);
(4)欲提高上述反应中CO的平衡转化率,可采取的措施是 ;
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(5)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,此时v正 v逆(填“等于”、“大于”或“小于”)。经过l0 min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v (CO2)= 。
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为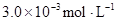 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA 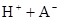 | 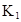 | 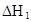 | 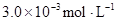 |
在苯中,2HA 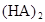 | 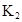 | 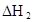 | 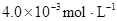 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA
 (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则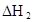 ___________0。
___________0。(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足
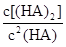 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。 工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)  CH3OH(g)+Q
CH3OH(g)+Q
(1)能判断反应达到平衡状态的依据是(填字母序号,下同)________。
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应Q________(填“>”、“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________。
(3)要提高CO的转化率,可以采取的措施是________。
a.升温;b.加入催化剂;c.增加CO的浓度;d.加入H2加压;e.加入惰性气体加压;f.分离出甲醇
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:___________________________________________________。
设反应①Fe(s)+CO2(g) FeO(s)+CO(g)△H=Q1的平衡常数为K1,
FeO(s)+CO(g)△H=Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
| 温度(T) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应;
(2)现有反应③H2(g)+CO2(g)
 CO(g)+H2O(g)△H=Q3
CO(g)+H2O(g)△H=Q3①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3=_____________;
 2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题: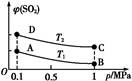
 xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白: