题目内容
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示.
(已知:2SO2 (g)+O2(g) 2SO3(g) △H=-196.6 KJ·mol-1)
2SO3(g) △H=-196.6 KJ·mol-1)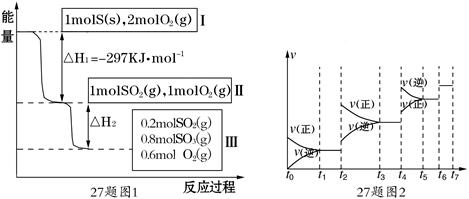
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: .
(2)ΔH2 =
(3)恒温恒容时,1molSO2和2molO 2充分反应,放出热量的数值比∣ΔH2 ∣ (填“大”、“小”或 “相等”)
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为 .
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有 .
a.升高温度;
b.充入He气
c.再充入1molSO2 (g)和1molO 2 (g)
d.使用催化剂
(6)某SO2 (g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率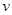 与时间t的关系如图2所示,若不改变SO2 (g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 .
与时间t的关系如图2所示,若不改变SO2 (g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 .
(共15分)
(1)S(s)+O 2(g)="=" SO2(g) ΔH=-297 KJ·mol-1(2分)
(2)-78.64(2分) (3)大(2分)
(4)2mol(2分);2SO2 +O 2 +4OH-==2SO42- +2H2O(1分)
(5)C(2分) (6)升高温度(2分);t3~t4(2分)
解析试题分析:
(1)由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以,硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297 KJ?mol-1。
(2)由图1可知,参加反应的n(SO2)=1mol-0.2mol=0.8mol,根据热化学方程式:
2SO2(g)+O2(g)  2SO3(g) △H=-196.6KJ?mol- 1;
2SO3(g) △H=-196.6KJ?mol- 1;
可知,△H2=0.4△H=0.4×(-196.6KJ?mol- 1)=-78.64KJ?mol-1。
(3)恒温恒容时,1molSO2和2molO2 与起始量1molSO2和1molO2 相比,增大了氧气的浓度,平衡正向移动,所以SO2的转化率高,放出热量的数值比|△H2|大。
(4)反应最后得到硫酸钠,根据钠原子、硫原子原子守恒,n(NaOH)=2n(S)=2×(0.2+0.8)mol=2mol。若发生氧化还原反应,则是SO2被O2氧化,离子方程式为2SO2+O2+4OH-═2SO42-+2H2O。
(5)a、反应为放热反应,温度升高,平衡逆向移动,n(SO3)减小,n(SO2)增大,
n(SO3)/n(SO2)减小,故a错误;
b、恒容条件下,充入氦气,反应混合物浓度不变,平衡不移动,n(SO3)/n(SO2)不变,故b错误;
c、再充入1molSO2(g)和1molO2 (g),等效为Ⅱ压强增大一倍,平衡正向移动,
n(SO3)/n(SO2)增大,故c正确;
d、使用催化剂,加快反应,平衡不移动,n(SO3)/n(SO2)不变,故d错误。
(6)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动。t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动。该反应为体积减小的放热反应,若升高温度,平衡逆向移动;若增大压强,平衡正向移动,故t2~t3段为增大压强,t4~t5段为升高温度;
t2~t3段为增大压强,平衡正向移动,SO3的含量升高,至t3~t4平衡时含量达最高。
考点:本题考查热化学方程式、化学平衡等,综合性高,难度大,关键在于读图获取信息,培养学生分析问题解决问题能力。

设反应①Fe(s)+CO2(g) FeO(s)+CO(g)△H=Q1的平衡常数为K1,
FeO(s)+CO(g)△H=Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
| 温度(T) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应;
(2)现有反应③H2(g)+CO2(g)
 CO(g)+H2O(g)△H=Q3
CO(g)+H2O(g)△H=Q3①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3=_____________;
已知A(g)+B(g)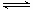 2 C(g)反应的平衡常数和温度的关系如下:
2 C(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
回答下列问题:
(1) 该反应的平衡常数表达式K=______,△H_____0(填“<”“>”“=”);
(2) 容积固定,判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.气体的密度不随时间改变 b. c(A)不随时间改变
c.混合气体平均相对分子质量不随时间改变 d. 压强不随时间改变
(3)1200℃时反应2C(g)
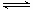 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。(4)830℃时,向一个10.00 L的密闭容器中充入0.40mol的A和1.60mol的B,如果反应初始2s内生成C的物质的量为0.40mol,则2s内A的平均反应速率v(A)= ____mol·L-1·s-1; 2s时c(B)= ____ mol·L-1; 2s时A的转化率为____;2s时C的体积分数为____。
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):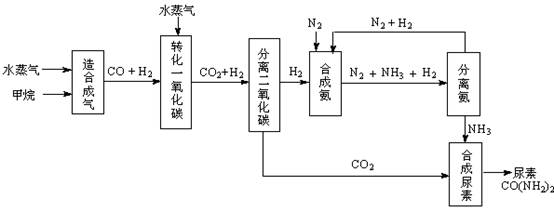
(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g) 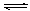 CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g) 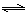 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
提高氢碳比[ n(H2O)/n(CO)],K值 (填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1∶3,此时v(正) v(逆)(填“>”、“=”或“<”)。
(3)有关合成氨工业的说法中正确的是 。
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3)∶n(CO2)的最佳配比为 ,而实际生产过程中,往往使n(NH3)∶n(CO2)≥3,这是因为 。
(5)当甲烷合成氨气的转化率为60%时,以3.0×108 L甲烷为原料能够合成 L 氨气。(假设体积均在标准状况下测定)
水煤气转化反应CO(g)+H2O(g)  CO2(g)+H2 (g)在一定温度下达到化学平衡状态。
CO2(g)+H2 (g)在一定温度下达到化学平衡状态。
完成下列填空:
(1)写出该反应的平衡常数表达式K=________________。
(2)一定温度下,在一个容积不变的密闭容器中发生上述反应,下列说法中能判断该反应达到化学平衡状态的是 (选填编号)。
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v正(CO) = v逆(H2O) d.c(CO) = c(H2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下实验组1和实验组2的数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 3 |
| 2 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 3 | 950 | 1 | 2 | — | — | — |
①由实验组1的数据可知,平衡时CO的转化率为 %。
②由实验组1和2的数据可分析,压强对该可逆反应的影响是 。
③有了实验组1和2的数据,再设计实验组3,其目的是 。
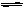 2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题: Si (s)+ 4HCl(g) -236kJ
Si (s)+ 4HCl(g) -236kJ 2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。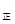 v
v (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。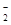 ,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。
,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。 N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。