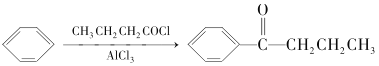
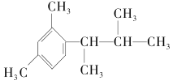
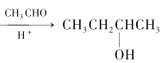题目内容
【题目】一定条件下,在体积固定的密闭容器中进行:N2(g)+3H2(g)![]() 2NH3(g),下列有关说法错误的是( )
2NH3(g),下列有关说法错误的是( )
A.达平衡时单位时间内生成氢气的物质的量与生成氨气的物质的量相同
B.使用催化剂可以加快反应速率,缩短达平衡时间
C.为了提高氢气的转化率,可以适当补充氮气
D.达平衡时,密闭容器中的气体的总物质的量比起始时的总物质的量小
【答案】A
【解析】
反应达到平衡的标志是随反应改变的的不再改变时反应达到平衡,据此解答。
A.达平衡时单位时间内生成氢气的物质的量与生成氨气的物质的量符合化学计量数之比,由方程式可知二者不相等,A错误;
B.催化剂可以改变反应速率,则使用催化剂可以加快反应速率,缩短达平衡时间,B正确;
C.为了提高氢气的转化率,则应使平衡正向移动,且不能增加氢气,当适当补充氮气时,会使平衡正向移动,提高氢气转化率,C正确;
D.由反应方程式可知:反应为气体分子数减少的反应,则随反应进行,气体的物质的量减小,达平衡时,密闭容器中的气体的总物质的量比起始时的总物质的量小,D正确;
故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
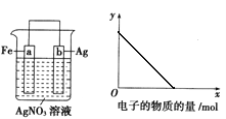
小学生10分钟应用题系列答案【题目】目前工业上有一种方法是用CO2生产燃料甲醇(CH3OH)。反应的化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
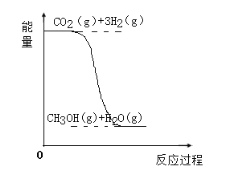
(1)该反应是__反应(填“吸热”或“放热”),判断的理由是___。
(2)某温度时,在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如下表所示:
时间/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.85 | 0.7 | 0.25 | 0.25 |
从反应开始到5min末,用CO2表示的该反应的平均速率为__;反应达平衡时,H2的转化率为__;要提高此反应的速率,可以采取___措施(填写2条)。
(3)若维持(2)的条件不变,能说明该反应已达平衡状态的是__(填序号)。
A.v生成(CH3OH)=v消耗(CO2)
B.CO2、H2、CH3OH、H2O浓度相等的状态
C.CO2、H2、CH3OH、H2O总物质的量保持不变的状态
D.CO2的转化率保持不变的状态
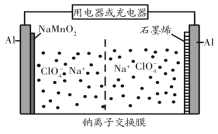
(4)依据原电池原理,将甲醇设计成燃料电池如图:
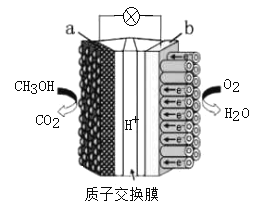
则a为__极(填“正”或“负”);H+从__极区向__极区迁移(用图中字母填);b极上O2发生反应电极反应式为:__。
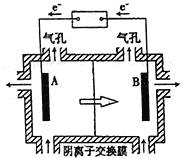
【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、Mg0少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属钰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:
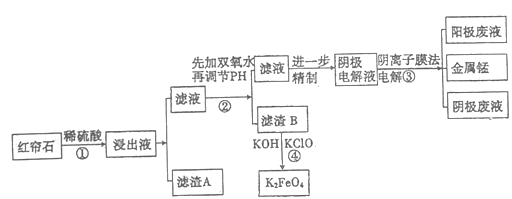
(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂:_______(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸 b.KOH c.氨水 d.MnCO3 e.CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_______________。
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;则与A电极连接的是直流电源的_____极。阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________。