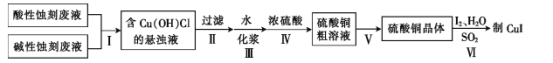
题目内容
【题目】我国科研团队成功研究出高比能量、低成本的钠离子二次电池,其工作原理示意图如图。已知电池反应:Na1-xMnO2+NaxCn![]() NaMnO2+nC。下列说法正确的是( )
NaMnO2+nC。下列说法正确的是( )
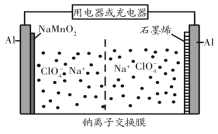
A.电池放电过程中,NaMnO2/Al上的电势低于石墨烯/Al上的电势
B.电池放电时,正极可发生反应Na1-xMnO2+xNa++xe-=NaMnO2
C.电池充电时,外接电源的负极连接NaMnO2/Al电极
D.电池充电时,Na+由NaMnO2/Al电极移向石墨烯/Al电极
【答案】BD
【解析】
放电过程总反应式为:Na1-xMnO2+NaxCn=nC+NaMnO2,可知C元素的化合价升高,Mn元素的化合价降低,则负极是石墨烯/Al,正极为NaMnO2/Al,则充电时石墨烯/Al发生还原反应为阴极,NaMnO2/Al发生氧化反应为阳极。
A.放电时NaMnO2/Al为正极,石墨烯/Al为负极,正极电势高于负极电势,故A错误;
B.放电时,正极得电子发生还原反应,根据总反应可知正极反应为Na1-xMnO2+xNa++xe-=NaMnO2,故B正确;
C.充电时NaMnO2/Al发生氧化反应为阳极,与外接电源的正极相连,故C错误;
D.充电时为电解池,电解池中阳离子流向阴极,即由NaMnO2/Al电极移向石墨烯/Al电极,故D正确;
故答案为BD。

练习册系列答案
相关题目