题目内容
16.取相同物质的量浓度、相同体积的(NH4)3PO4,(NH4)2HPO4,NH4H2PO4种溶液,分别滴加NaOH溶液直至恰好完全反应,则3种溶液耗用NaOH溶液的体积之比是( )| A. | 1:2:3 | B. | 3:2:1 | C. | 1:1:1 | D. | 6:3:2 |
分析 体积相同、物质的量浓度相同的(NH4)3PO4、(NH4)2HPO4和NH4H2PO4溶液中各溶质的物质的量相等,与NaOH溶液分别发生反应:(NH4)3PO4+3NaOH=Na3PO4+3NH3•H2O、(NH4)2HPO4+3NaOH=Na3PO4+H2O+2NH3•H2O、NH4H2PO4+3NaOH=Na3PO4+2H2O+NH3•H2O,由方程式可知消耗的NaOH的物质的量相等,再根据v=$\frac{n}{c}$进行判断.
解答 解:体积相同、物质的量浓度相同的(NH4)3PO4、(NH4)2HPO4和NH4H2PO4溶液中各溶质的物质的量相等,与NaOH溶液分别发生反应:(NH4)3PO4+3NaOH=Na3PO4+3NH3•H2O、(NH4)2HPO4+3NaOH=Na3PO4+H2O+2NH3•H2O、NH4H2PO4+3NaOH=Na3PO4+2H2O+NH3•H2O,由方程式可知消耗的NaOH的物质的量相等,NaOH的浓度相同,故消耗NaOH溶液的体积相等,即三者与物质的量浓度相等的氢氧化钠溶液完全反应所需要的体积比为1:1:1,
故选C.
点评 本题考查物质的量浓度有关计算,难度不大,清楚发生的反应式解题的关键,注意利用方程式进行计算.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 7.8 g Na2O2中含有的阴离子数为0.1NA | |
| B. | 常温下,含0.1 mol碳酸钠的溶液中含有CO${\;}_{3}^{2-}$的个数为0.1NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中,含有的阳离子数目为0.1NA | |
| D. | 12 g NaHSO4晶体中阳离子和阴离子的总数为0.3NA |
4.下列离子能在pH=1的无色溶液中大量共存的是( )
| A. | Cu2+、SO42-、Cl-、Na+ | B. | OH-、K+、NO3-、Ba2+ | ||
| C. | Na+、CO32-、Ca2+、Cl- | D. | Mg2+、SO42-、Al3+、NO3- |
1.下列离子方程式正确的是( )
| A. | 向Fe(NO3)3 溶液中滴入少量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 向AlCl3 溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Cu(OH)2沉淀溶于氨水得到深蓝色溶液:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O | |
| D. | 澄清石灰水中加入少量NaHCO3 溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
8.有一类有机硅化合物中只含有硅元素和氢元素,叫硅烷,它们的分子组成与烷烃相似,其中有一种结构最简单的硅烷叫甲硅烷(SiH4),则有关描述不正确的是( )
| A. | 硅烷的分子通式可表示为SinH2n+2 | B. | 甲硅烷燃烧生成SiO2和H2O | ||
| C. | 甲硅烷的沸点高于甲烷 | D. | 甲硅烷的稳定性比甲烷强 |
5.从植物中提取如图有机物的合理方法是( )
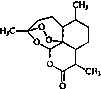

| A. | 用冷水浸泡 | B. | 用乙醚浸泡 | ||
| C. | 用热NaOH溶液浸泡 | D. | 高温灼烧 |

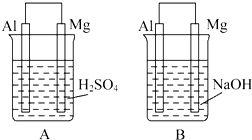 有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质.分别设计如图所示的原电池,请完成以下问题:
有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质.分别设计如图所示的原电池,请完成以下问题: