题目内容
4.下列离子能在pH=1的无色溶液中大量共存的是( )| A. | Cu2+、SO42-、Cl-、Na+ | B. | OH-、K+、NO3-、Ba2+ | ||
| C. | Na+、CO32-、Ca2+、Cl- | D. | Mg2+、SO42-、Al3+、NO3- |
分析 pH=1的无色溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.Cu2+为蓝色,与无色不符,故A不选;
B.酸性溶液中不能大量存在OH-,故B不选;
C.酸性溶液中不能大量存在CO32-,且CO32-、Ca2+结合生成沉淀,不能大量共存,故C不选;
D.酸性溶液中该组离子之间不反应,可大量共存,且离子均为无色,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
8.在101kPa和298K时,有关反应的热化学方程式有:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | O2前面的$\frac{1}{2}$表示参加反应的O2的分子数目 | |
| C. | 燃烧热是以在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量定义的,则H2的燃烧热为285.8 kJ•mol-1 | |
| D. | 1 mol H2和$\frac{1}{2}$ mol O2所具有的总能量大于1mol H2O(g)所具有的总能量 |
12.现有部分元素的性质与原子(或分子)结构如表所示:
(1)写出元素T的原子结构示意图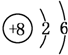 .
.
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式 .
.
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
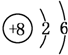 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式
 .
.
19.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
(1)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4;
(2)比较①与⑤的最高价氧化物对应的水化物,酸性强的是H2CO3(填化学式);能通过说明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(写反应的化学方程式).
(3)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因3NO2+H2O=2HNO3+NO(用化学方程式表示)
(5)比较③与⑥的氢化物,更稳定H2O(填化学式)
(6)③④两元素组成的化合物A2B2型电子式为: ,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
(7)⑨的单质与水反应所得离子化合物中阳离子半径<S2-(填“>”或“<”).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)比较①与⑤的最高价氧化物对应的水化物,酸性强的是H2CO3(填化学式);能通过说明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(写反应的化学方程式).
(3)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因3NO2+H2O=2HNO3+NO(用化学方程式表示)
(5)比较③与⑥的氢化物,更稳定H2O(填化学式)
(6)③④两元素组成的化合物A2B2型电子式为:
 ,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.(7)⑨的单质与水反应所得离子化合物中阳离子半径<S2-(填“>”或“<”).
16.取相同物质的量浓度、相同体积的(NH4)3PO4,(NH4)2HPO4,NH4H2PO4种溶液,分别滴加NaOH溶液直至恰好完全反应,则3种溶液耗用NaOH溶液的体积之比是( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 1:1:1 | D. | 6:3:2 |
14.下列关于乙酸性质的叙述中,不正确的是( )
| A. | 纯净的乙酸又称为冰醋酸 | B. | 乙酸能与金属钠反应放出氢气 | ||
| C. | 乙酸的酸性比碳酸强 | D. | 乙酸与乙醇不互溶 |