题目内容
【题目】可逆反应 N2(g)+3H2(g)![]() 2NH3(g),在500℃时,将2molN2和2molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
2NH3(g),在500℃时,将2molN2和2molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
A.0.01mol·L-1B.0.02mol·L-1
C.0.05mol·L-1D.0.15mol·L-1
【答案】D
【解析】
可逆反应不能进行到底,利用极限转化法计算出氨气的最大浓度即可解答。
该反应为可逆反应,可逆反应不能进行到底.假设反应完全进行,由化学方程式N2(g)+3H2(g)![]() 2NH3(g),知2molN2过量,因而2molH2完全反应生成
2NH3(g),知2molN2过量,因而2molH2完全反应生成![]() mol NH3,故NH3的浓度肯定小于
mol NH3,故NH3的浓度肯定小于![]() mol
mol![]() 10L=0.13mol/L,不可能达到0.15 mol·L-1,所以选项D是不可能的,
10L=0.13mol/L,不可能达到0.15 mol·L-1,所以选项D是不可能的,
答案选D。

 阅读快车系列答案
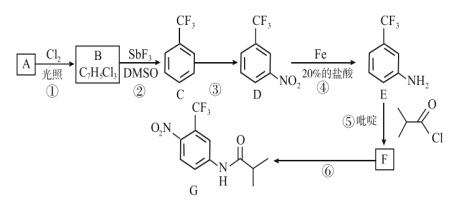
阅读快车系列答案【题目】某学习小组探究铁与氯气的反应途径及产物。
(问题提出)
(1)资料1:液氯能在钢瓶中储存。
资料2:铁与氯气在加热条件下能发生反应
资料3:铁与氯水能反应。实验:将铁粉放入氯水中,铁粉溶解,无气泡产生。
①经检验氯水呈酸性,原因是________(用化学方程式表示)。
②依据实验现象,判断氯水中与Fe反应的微粒可能为_________。
据此,小组认为Fe与Cl2的反应与温度、湿度有关,探究如下。
(实验探究) 资料:高于300℃时FeCl3升华
(2)湿润的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅰ |
| 常温时将铁丝伸入A中,铁丝迅速变黑 |
Ⅱ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
①实验Ⅰ,向A中加水,经检验产物中有FeCl2,推测其形成的可能途径:
途径一: Fe + Cl2 = FeCl2
途径二: 2Fe + 3Cl2 = 2FeCl3,_________。
②实验Ⅱ,_________(填操作和现象),A中产物含+3价铁。
(3)干燥的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅲ |
| 常温时将铁丝伸入A中, 铁丝慢慢变 黑,大量气体剩余。 |
Ⅳ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
实验Ⅲ中有大量Cl2剩余,实验Ⅳ几乎无Cl2剩余,原因是________。
【题目】在体积为2L的恒容密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)反应在三种不同的条件下进行,反应物SO2的物质的量(mol)随反应时间(min)的变化情况如下表所示:
2SO3(g)反应在三种不同的条件下进行,反应物SO2的物质的量(mol)随反应时间(min)的变化情况如下表所示:
实验序号 | 时间 物质的量 温度 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
1 | 490℃ | 2.00 | 1.00 | 0.50 | 0.30 | 0.25 | 0.20 | 0.20 |
2 | 490℃ | 2.00 | 0.30 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
3 | 500℃ | 2.00 | 0.50 | 0.35 | 0.30 | 0.30 | 0.30 | 0.30 |
(1)对照实验1,实验2改变的某一外界条件可能是_______。
(2)反应达平衡后,向实验2中加入少量的18O2,一段时间18O后可能存在于哪些物质中________(填选项)。
A 只存在氧气 B 只存在三氧化硫 C 只存在反应物 D 存在反应物与生成物
(3)实验3中,在5~15min时段,用O2表示的平均反应速率为______ mol/(L·min)。
(4)若将实验1置于绝热体系中,测得实验到达平衡的时间比原来缩短了,则参加反应的SO2和O2的总能量______(填“>”、“<”或“=”)生成的SO3的总能量。
(5)能说明实验3达到平衡状态的标志是_______(任写一条)。