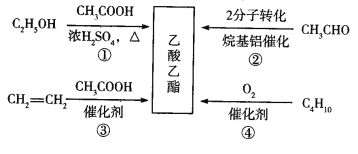
题目内容
【题目】现代高科技领域使用的新型陶瓷材料氮化硼(BN),用天然硼砂(Na2B4O710H2O)经过下列过程可以制得。
天然硼砂![]() 硼酸(H3BO3)
硼酸(H3BO3)![]() B2O3
B2O3![]() BN
BN
(1)天然硼砂所含的元素中属于同一周期且原子半径是(用元素符号填写)___>___,由天然硼砂中的三种元素形成的某种离子化合物的电子式为______。
(2)与硼元素性质最相似的元素的原子的最外层电子排布为_______,该原子核外充有电子的轨道共有____个。
(3)试写出天然硼砂与硫酸反应的化学方程式_______,制得的氮化硼有不同的结构,其中超硬、耐磨、耐高温的一种属于____晶体。制取氮化硼的反应必须在密闭的耐高温容器中进行:B2O3(s)+2NH3(g)![]() 2BN(s)+3H2O(g)+Q(Q<0)
2BN(s)+3H2O(g)+Q(Q<0)
(4)若反应在5L的密闭容器中进行,经2分钟反应炉内固体的质量减少60.0g,则用氨气来表示该反应在2分钟内的平均速率为_____,达到平衡后,增大反应容器体积,在平衡移动过程中,逆反应速率的变化状况为______。
(5)为提高生产效率,使反应速率加快的同时,化学平衡向多出产品的方向移动,可以采取的措施有_________,生产中对尾气的处理方法正确的是(填序号)_____。
A.直接排出参与大气循环 B.冷却分离所得气体可以循环使用
C.全部用来进行循环使用 D.冷却分离所得液体可作化工原料
【答案】B O ![]() 3s23p2 8 Na2B4O710H2O+H2SO4→Na2SO4+4H3BO3+5H2O 原子 0.6mol/(L·min) 先减小后增大 升高温度、通入氨气 BD
3s23p2 8 Na2B4O710H2O+H2SO4→Na2SO4+4H3BO3+5H2O 原子 0.6mol/(L·min) 先减小后增大 升高温度、通入氨气 BD
【解析】
(1)Na、B、O、H四种元素中属于同一周期的是B、O,原子半径:B>O;Na、O、H三种元素可形成离子化合物NaOH;
(2)与硼元素性质最相似的元素为硅;
(3)Na2B4O710H2O与硫酸反应得到硼酸,根据原子守恒,写出化学方程式;根据晶体具有超硬、耐磨、耐高温的性质,氮化硼属于原子晶体;
(4)根据![]() =
=![]() 计算反应速率;根据浓度对化学反应速率的影响分析逆反应速率的变化;
计算反应速率;根据浓度对化学反应速率的影响分析逆反应速率的变化;
(5)根据B2O3(s)+2NH3(g)![]() 2BN(s)+3H2O(g)+Q(Q<0),正反应为吸热反应,升高温度、通入氨气平衡向正反应方向移动;根据尾气中含有NH3和水蒸气,分析尾气处理方法。
2BN(s)+3H2O(g)+Q(Q<0),正反应为吸热反应,升高温度、通入氨气平衡向正反应方向移动;根据尾气中含有NH3和水蒸气,分析尾气处理方法。
(1)天然硼砂(Na2B4O710H2O)含有Na、B、O、H四种元素,其中Na位于第三周期,B、O位于第二周期,H位于第一周期,属于同一周期的是B、O,原子半径:B>O,Na、O、H三种元素可形成离子化合物NaOH,其电子式为![]() ,故答案为:B;O;
,故答案为:B;O;![]() ;
;
(2)硼元素位于元素周期表第二周期第ⅢA族,根据对角线规则,与硼元素性质最相似的元素为第三周期第ⅣA族的硅元素,Si原子的最外层电子排布为3s23p2,该原子核外电子排布式为1s22s2p63s23p2,因此该原子核外充有电子的轨道共有共有8个。故答案为:3s23p2;8;
(3)Na2B4O710H2O与硫酸反应得到硼酸,根据原子守恒,化学方程式为Na2B4O710H2O+H2SO4→Na2SO4+4H3BO3+5H2O;原子晶体具有超硬、耐磨、耐高温的性质,故氮化硼属于原子晶体。故答案为:Na2B4O710H2O+H2SO4→Na2SO4+4H3BO3+5H2O;原子;
(4)根据质量守恒定律,固体质量减少等于气体质量的增加,设反应的NH3的质量为x,
B2O3(s)+2NH3(g)![]() 2BN(s)+3H2O(g), 质量差
2BN(s)+3H2O(g), 质量差
2×17 3×18 20
x 60.0g
![]() =
=![]() ,x=102g,
,x=102g,
则用氨气来表示该反应在2分钟内的平速率为![]() =0.6mol/(L·min);达到平衡后,增大反应容器体积,H2O(g)的浓度减小,逆反应速率减小,由于减小压强平衡正向移动,随着反应进行,H2O(g)的浓度又逐渐增大,所以逆反应速率先减小后增大;故答案为:0.6mol/(L·min);先减小后增大;
=0.6mol/(L·min);达到平衡后,增大反应容器体积,H2O(g)的浓度减小,逆反应速率减小,由于减小压强平衡正向移动,随着反应进行,H2O(g)的浓度又逐渐增大,所以逆反应速率先减小后增大;故答案为:0.6mol/(L·min);先减小后增大;
(5)根据B2O3(s)+2NH3(g)![]() 2BN(s)+3H2O(g)+Q(Q<0),正反应为吸热反应,升高温度、通入氨气使反应速率加快的同时,化学平衡向多出产品的方向移动;由反应过程可知,尾气中含有未反应的NH3和生成的水蒸气,则
2BN(s)+3H2O(g)+Q(Q<0),正反应为吸热反应,升高温度、通入氨气使反应速率加快的同时,化学平衡向多出产品的方向移动;由反应过程可知,尾气中含有未反应的NH3和生成的水蒸气,则
A.NH3直接排出参与大气循环会污染空气,故A错误;
B.冷却分离所得NH3可以循环使用,有利于原料充分利用和环境保护,故B正确;
C.由反应B2O3(s)+2NH3(g)![]() 2BN(s)+3H2O(g)可知,生成的水蒸气不用来进行循环使用,故C错误;
2BN(s)+3H2O(g)可知,生成的水蒸气不用来进行循环使用,故C错误;
D.尾气中含有NH3和水蒸气,冷却分离后得到氨水,可作化工原料,故D正确。
综合上述分析,BD正确。故答案为:升高温度、通入氨气;BD。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案