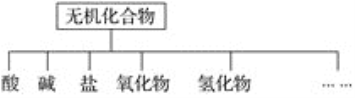
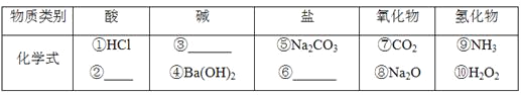
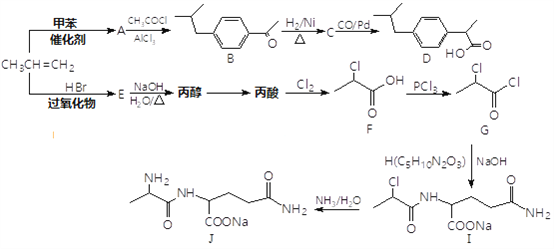
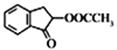
题目内容
【题目】如图所示是过氧化氢(H2O2)分子的空间结构示意图。
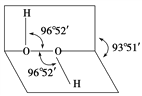
(1)写出过氧化氢分子的电子式________。
(2)下列关于过氧化氢的说法中正确的是(填序号)____。
①分子中有极性键 ②分子中有非极性键 ③氧原子的轨道发生了sp2杂化 ④O—O共价键是p—pσ键 ⑤分子是非极性分子
(3)过氧化氢分子之间易形成氢键,该氢键的表示式是____________。
(4)过氧化氢难溶于二硫化碳,主要原因是______________________;过氧化氢易溶于水,主要原因是________________________。
(5)过氧乙酸也是一种过氧化物,它可以看作是过氧化氢分子中的一个氢原子被乙酰基(CH3CO)取代的产物,是一种常用的杀菌消毒剂。在酸性条件下过氧乙酸易发生水解反应生成过氧化氢。
①写出过氧乙酸发生水解反应的化学方程式(有机物用结构简式表示):____________。
②过氧乙酸用作杀菌消毒剂的原因是________________________________________。
【答案】 ![]() ①② O-H…O H2O2是极性分子,CS2是非极性分子,依据相似相溶的原理可知,H2O2难溶于CS2 H2O2中氧元素的电负性很强,H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
①② O-H…O H2O2是极性分子,CS2是非极性分子,依据相似相溶的原理可知,H2O2难溶于CS2 H2O2中氧元素的电负性很强,H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶  +H2O→CH3COOH+H2O2 过氧乙酸分子中有O-O键,有强氧化性
+H2O→CH3COOH+H2O2 过氧乙酸分子中有O-O键,有强氧化性
【解析】(1)过氧化氢的电子式为![]() ;(2)①H-O为极性键,故①正确;②O-O为非极性键,故②正确;③由H2O2的结构可知,O原子形成1个O-H键、1个O-O键,含有2对孤对电子,杂化轨道数为4,杂化方式为sp3,故③错误;④O的s轨道电子和O的s轨道电子成键,故是s-sσ键,故④错误;⑤过氧化氢中的键的极性不能相互抵消,是极性分子,⑤错误;答案选①②;(3)O元素的电负性很强,O原子与H原子之间可以形成氢键,该氢键的表示式为O-H…O;(4)H2O2是极性分子,CS2是非极性分子,依据相似相溶的原理可知,H2O2难溶于CS2;H2O2中氧元素的电负性很强,H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶;(5)①过氧乙酸发生水解反应的化学方程式为:
;(2)①H-O为极性键,故①正确;②O-O为非极性键,故②正确;③由H2O2的结构可知,O原子形成1个O-H键、1个O-O键,含有2对孤对电子,杂化轨道数为4,杂化方式为sp3,故③错误;④O的s轨道电子和O的s轨道电子成键,故是s-sσ键,故④错误;⑤过氧化氢中的键的极性不能相互抵消,是极性分子,⑤错误;答案选①②;(3)O元素的电负性很强,O原子与H原子之间可以形成氢键,该氢键的表示式为O-H…O;(4)H2O2是极性分子,CS2是非极性分子,依据相似相溶的原理可知,H2O2难溶于CS2;H2O2中氧元素的电负性很强,H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶;(5)①过氧乙酸发生水解反应的化学方程式为: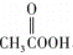 +H2O→CH3COOH+H2O2;②过氧乙酸用作杀菌消毒剂的原因是过氧乙酸分子中有O-O键,有强氧化性。
+H2O→CH3COOH+H2O2;②过氧乙酸用作杀菌消毒剂的原因是过氧乙酸分子中有O-O键,有强氧化性。

【题目】判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性强弱相差很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可知它们的结构式分别为①__________,②__________。
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①__________,②__________。
(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况__________,写出反应的化学方程式________________________________________________________________________。