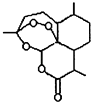
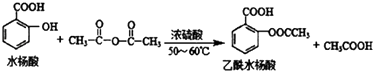
题目内容
【题目】铁红(主要成分为Fe2O3)是一种用途广泛的颜料,用废铁屑制备铁红的流程如下:

(1)操作Ⅰ的名称是_________。
(2)检验FeCO3沉淀是否洗净的实验方法是________。
(3)加入NH4HCO3溶液的反应除了生成FeCO3沉淀,还会生成一种气体,生成气体的离子方程式为________。
(4)在空气中煅烧FeCO3的化学方程式是________,若煅烧不充分,产品Fe2O3中会有FeO,为了避免产品中有FeO,可以采取的措施是________。
(5)称取3.0 g 产品,用稀硫酸溶解,逐滴加入0.10 mol·L-1 KMnO4溶液20.00 mL,二者恰好反应完全。若此产品中只含有FeO、Fe2O3,求算产品中Fe2O3的质量分数,写出计算过程___。
(已知:10FeSO4+2KMnO4+8H2SO4===5Fe2(SO4)3+2MnSO4+K2SO4+8H2O)
【答案】 过滤 取最后一次洗涤液少量于试管中,加入盐酸无现象,再加入BaCl2溶液,若无白色沉淀生成,则洗净 H++HCO3-=CO2↑+H2O (写成Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 也对) 4FeCO3+O2 ![]() 2Fe2O3+4CO2 粉碎FeCO3(或“升高温度”、“加长时间”意思,答对一项即可) 76%
2Fe2O3+4CO2 粉碎FeCO3(或“升高温度”、“加长时间”意思,答对一项即可) 76%
【解析】试题分析:(1)Ⅰ是把沉淀和废液分离的操作;(2)检验FeCO3沉淀是否洗净,可以检验洗涤液中是否含有SO42-;(3)FeSO4溶液呈酸性,加入NH4HCO3溶液,H+与HCO3-反应生成CO2气体;(4)在空气中煅烧FeCO3,FeCO3被氧气氧化为Fe2O3;为充分煅烧,可以将FeCO3粉碎、升高温度、加长时间煅烧时间等;(5)根据关系式5FeO![]() ,计算FeO的质量。
,计算FeO的质量。
解析:(1)Ⅰ是把沉淀和废液分离的操作,操作Ⅰ的名称是过滤;(2)固体表面可能带有SO42-,检验FeCO3沉淀是否洗净,可以检验洗涤液中是否含有SO42-,取最后一次洗涤液少量于试管中,加入盐酸无现象,再加入BaCl2溶液,若无白色沉淀生成,则洗净;(3)FeSO4溶液呈酸性,加入NH4HCO3溶液,H+与HCO3-反应生成CO2气体,反应离子方程式是H++HCO3-=CO2↑+H2O;(4)在空气中煅烧FeCO3,FeCO3被氧气氧化为Fe2O3,煅烧的方程式是4FeCO3+O2 ![]() 2Fe2O3+4CO2;为充分煅烧,可以将FeCO3粉碎、升高温度、加长时间煅烧时间等;
2Fe2O3+4CO2;为充分煅烧,可以将FeCO3粉碎、升高温度、加长时间煅烧时间等;
(5)设样品含FeO的质量是xg。
根据关系式
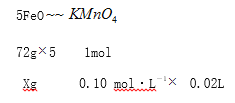
![]()
X=0.72g,产品中Fe2O3的质量分数![]() 76%。
76%。

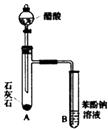
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。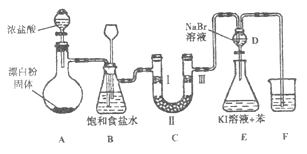
(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:。
(2)装置B中饱和食盐水的作用是;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是(填字母编号)。
编号 | I | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 , 该现象(填“能”或“不能”) 说明溴单质的氧化性强于碘,原因是。
(5)装置F的烧杯中的溶液不能选用下列中的(填字母编号)。a.饱和NaOH溶液 b.饱和Ca(OH)2溶液 c.饱和Na2CO3溶液