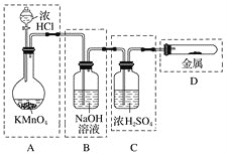
题目内容
【题目】下列说法中,正确的是 ( )
A. 冰融化时,分子中H—O键发生断裂
B. 原子晶体中,共价键的键长越短,通常熔点就越高
C. 分子晶体中,共价键键能越大,该分子的熔沸点就越高
D. 分子晶体中,分子间作用力越大,则分子越稳定
【答案】B
【解析】
试题A.冰熔化克服氢键,属于物理变化,H-O键没有断裂,故A错误;B.影响原子晶体熔沸点高低的因素是键能的大小,共价键的键长越短,键能越大,熔点就越高,故B正确;C.影响分子晶体熔沸点高低的因素是相对分子质量大小,与共价键的键能无关,故C错误;D.分子的稳定性与分子间作用力无关,稳定性属于化学性质,分子间作用力影响物理性质,故D错误。故选B。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高( )
A.所用NaOH已经潮解B.有少量NaOH溶液残留在烧杯里
C.向容量瓶中加水未到刻度线D.称量时误用“左码右物”
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。

(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。