题目内容
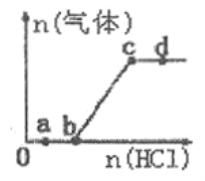
【题目】将等物质的量的金属Na、Mg、Al分别与100mL2mol/L盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法不正确的是( )

A. x=2.24
B. 反应时,Na、Mg、Al均过量
C. 钠的物质的量为0.2 mol
D. 曲线b为Mg与盐酸反应的图像
【答案】B
【解析】
由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数因该是不一样的,比值应是1:2:3,故推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余,由此分析。
A、由于酸不足,所以生成氢气的量为n(H2)=0.5n(HCl)=0.5×0.1L×2mol/L=0.1mol,所以标况下的体积为2.24L,故A正确;
B、Na不可能过量,即使过量也要与溶剂水反应,故B错误;
C、生成0.1mol的氢气需0.2mol的钠,故C正确;
D、按照金属活动性顺序Na>Mg>Al可知钠和盐酸反应最激烈,产生相同的氢气需要的时间最少,故中间那条线是Mg与盐酸反应的图像,故D正确;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。

(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。