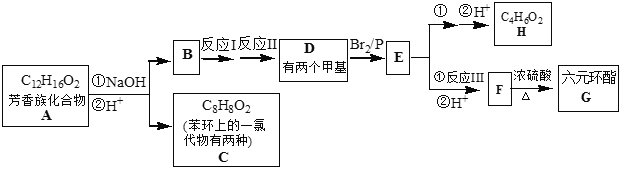
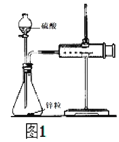
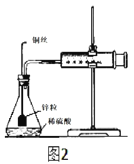
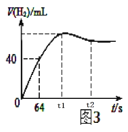
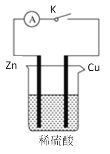
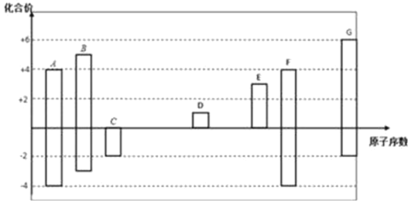
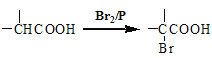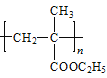题目内容
【题目】羰基硫(COS)可作为熏蒸剂,分子结构与(CO2)相似。回答下列问题:
(1) 碳原子的核外电子排布式为____;组成羰基硫的元素中,半径最大的原子其核外有____种不同能量的电子。
(2)羰基硫为____(填“极性”或“非极性”)分子,羰基硫的电子式为____。
(3)解释稳定性 CO2 大于 CS2 的原因____________________
【答案】1s22s22p2 5 极性 ![]() C=O 双键键能大于 C=S 双键键能,所以稳定性 CO2 大于 CS2。
C=O 双键键能大于 C=S 双键键能,所以稳定性 CO2 大于 CS2。
【解析】
(1) 碳原子的核外电子排布式为:1s22s22p2;电子层数越多,原子半径越大,电子层数相同的,原子序数越大,半径越小,则原子半径:S>C>O,则S原子的半径最大结合电子排布式1s22s22p63s23p4,同一轨道电子能量相同,则有5种能量不同的电子,
故答案为:1s22s22p2;5;
(2) 羰基硫中碳氧双键与碳硫双键的极性不同,所以羰基硫分子为极性分子;羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为![]() ;
;
故答案为:极性;![]() ;
;
(3) 解释稳定性CO2大于CS2的原因C=O双键键能大于C=S双键键能所以稳定性CO2大于CS2,
故答案为:C=O双键键能大于C=S双键键能所以稳定性CO2大于CS2。

【题目】下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___,形成的单质是半导体的是___(填元素名称)。
(2)⑥与⑨形成的化合物的电子式为___,①与②形成的最简单化合物的结构式为___。
(3
(4)气态氢化物最稳定的是___(填化学式),②、③、⑧的原子半径最小是__(填素符号)。
(5)④与⑧形成的化合物的属于___(填“离子化合物”或“共价化合物”),该晶体属于___晶体(填“离子”、“分子”、“原子”)。
【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液 2Cl-+2H2O | 用惰性电极电解MgBr2溶液 2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性 H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性 H++OH-=H2O |
A.AB.BC.CD.D