题目内容
【题目】如图是部分短周期元素的常见化合价与原子序数的关系图,请回答:
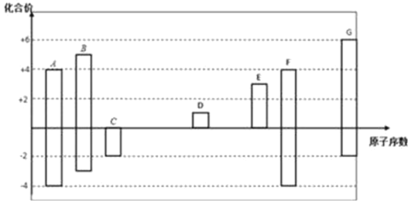
(1)元素F在周期表中的位置是___________________________。
(2)C2﹣、D+、G2﹣离子半径大小顺序是______________(用离子符号回答)。
(3)C和G的氢化物中,沸点较低的是______(填化学式),
因为____________________________________________。
(4)A与C形成化合物AC2的结构式为_______________,D的最高价氧化物的水化物的电子式为___________________。
(5)用电子式表示D与G元素形成化合物的过程______________________
【答案】第三周期第IVA族 S2->O2->Na+ H2S 水分子间形成了氢键 O=C=O ![]()
![]()
【解析】
根据图中原子序数与化合价的变化规律,得到A为C,B为N,C为O,D为Na,E为Al,F为Si,G为S。
(1)元素F为Si,核外有14个电子,电子排布分别为2、8、4,因此在周期表中的位置是第三周期第IVA族;故答案为:第三周期第IVA族。
(2)根据层多径大,同电子层结构中序多径小原则,得到O2、Na+、S2离子半径大小顺序是S2>O2>Na+;故答案为:S2>O2>Na+。
(3)C和G的氢化物中,沸点较低的是H2S,因为水分子间形成了氢键;故答案为:H2S;水分子间形成了氢键。
(4)A与C形成化合物CO2,其碳氧之间共用两对电子,因此其结构式为O=C=O,D的最高价氧化物的水化物为NaOH,是离子化合物,其电子式为![]() ;故答案为:O=C=O;
;故答案为:O=C=O;![]() 。
。
(5)Na和S形成的化合物Na2S,电子式表示Na2S形成化合物的过程为![]() ;故答案为:
;故答案为:![]() 。
。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目