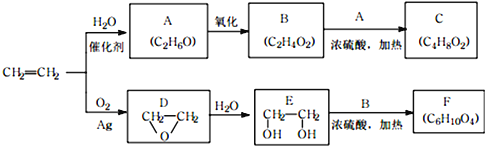
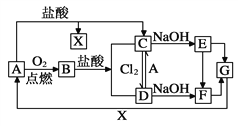
题目内容
【题目】采用图1实验装置测定锌与稀硫酸反应的速率。
(1)检查图1装置气密性的操作方法是_____。
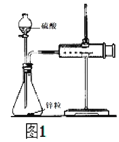
(2)分别取2g颗粒大小相同的锌粒分别与体积均为40mL的1mol/L硫酸、4mol/L硫酸反应,收集25mLH2时所需时间后者比前者_____。(填“长”或“短”)
(3)同学们在实验操作中发现本实验设计存在明显不足,例如_____。
(4)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:_____。
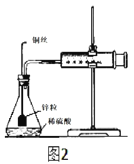
a.在多孔塑料袋中装入锌粒
b.在锥形瓶中加入40mL1mol/L硫酸
c.塞好橡胶塞,时立即用秒表计时
d.注射器内每增加5mL气体时读取一次秒表
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是_____,反应进行一定时间后速率逐渐减慢,原因是_____。
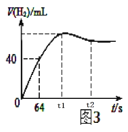
(6)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是_____;在64s内用H+浓度表示的平均反应速率v(H+)=______(此时,溶液体积仍为40mL,气体摩尔体积25L/mol)。
【答案】关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好 短 分液漏斗中溶液滴下占据体积引起气体体积读数误差或收集25mLH2时所需时间太短 多孔塑料袋浸入稀硫酸 反应放热,温度升高反应速率加快;酸中氢离子浓度减小 气体遇冷体积变小 v(H+)=0.00125mol/(L·s)
【解析】
(1)使装置内外形成气压差是气密性检查的常用手段检查该装置的气密性可关闭分液漏斗活塞,向外拉注射器的内管- -段距离后松手,若内管能回到开始位置证明气密性好,若不能则说明气密性不好;
(2) 1mol/L硫酸浓度小于4mol/L硫酸,化学反应速率后者快,收集25mL H2时所需时间后者比前者短;
(3)本实验设计存在明显不足,长颈漏斗的使用不能达到实验目的,应该改为分液漏斗,其次是反应速率太快,收集25mLH2时所需时间间隔太短,不易计时;
(4)产生一定体积的气体所需要的时间来确定反应速率时,在物质混合后就应该计时;
(5)观察到锌与稀硫酸反应初期,反应放热;温度升高,反应速率加快;反应进行一定时间后,酸中氢离子浓度减小,反应速率减慢;
(6)在金属锌和硫酸的反应中接近反应的最后阶段,因为气体的热胀冷缩性质,会发现气体的体积突然减小,根据金属锌和硫酸反应:Zn+2H+= Zn2++ H2↑,产生氢气40mL时,![]()
![]() ,
,![]() ,
,![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】工业制硫酸在接触室中发生的主要反应为2SO2(g)+O2(g)![]() 2SO3(g)。在一定温度下,向2L密闭容器内投入4molSO2(g)和2molO2(g)发生上述反应,n(SO2)随时间的变化如表所示:
2SO3(g)。在一定温度下,向2L密闭容器内投入4molSO2(g)和2molO2(g)发生上述反应,n(SO2)随时间的变化如表所示:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(SO2)(mol) | 4 | 3.2 | 1.6 | 1.4 | 1.4 |
(1)用SO3表示从0~2s内该反应的平均速率v(SO3)=___。
(2)该反应达到最大限度时SO2的转化率为___。
(提示:转化率=![]() ×100%)
×100%)
(3)该反应达到最大限度时O2的浓度为___。
(4)下列叙述能说明上述反应达到平衡状态的是___。
A.容器内压强保持不变
B.v(SO2)=2v(O2)
C.SO3的浓度不再变化
D.SO2、O2、SO3为浓度之比为2∶1∶2
E.单位时间内每消耗2molSO2,同时生成2molSO3