题目内容
中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池。如图,下列有关分析正确的是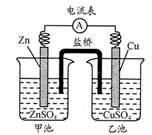
| A.负极发生氧化反应:Cu—2e—=Cu2+ |
| B.电池工作时,盐桥逐渐变蓝 |
| C.向乙池中通入H2S后,电池反应停止 |
| D.若将电极Cu改为石墨,电池电流强度发生变化 |
D
解析试题分析:A、Zn的活泼性大于Cu,所以负极上Zn失电子,错误;B、Cu2+不会向甲池移动,所以盐桥不会变蓝,错误;C、向乙池中通入H2S后,H2S与CuSO4反应生成CuS沉淀和H2SO4,电极上发生H+得电子生成H2的反应,电池继续反应,错误;D、若将电极Cu改为石墨,正负极的活泼性的差距变化,所以电池电流强度发生变化,正确。
考点:本题考查原电池原理。

练习册系列答案
相关题目
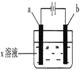
如图所示,下列实验现象的描述正确的是
| | a电极 | b电极 | x溶液 | 实 验 现 象 |
| A | 石墨 | 石墨 | CuCl2 | a极质量增加,b极放出无色气体 |
| B | Fe | 石墨 | KNO3 | a极质量增加,b极放出无色气体 |
| C | Fe | Cu | CuSO4 | a极质量增加,b极质量减少 |
| D | 石墨 | 石墨 | HCl | a极放出无色气体,b极放出无色气体 |
钢铁发生吸氧腐蚀时,正极上发生的电极反应是 ( )
| A.2H++2e-=H2↑ | B.Fe2++2e-=Fe |
| C.2H2O+O2+4e-=4OH- | D.Fe3++e-=Fe2+ |
下列说法中正确的是
| A.在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 |
| B.粗铜精炼时,电解液中的c(Cu2+)保持不变 |
| C.Na+的焰色反应呈黄色,属于化学变化 |
| D.在滴定实验中,可以用碱式滴定管量取21.0 mL的NaOH溶液 |
有如表所示三个实验
| 实验1 | 将金属X与金属Y用导线连接,浸入电解质溶液中,Y不易被腐蚀 |
| 实验2 | 将片状的金属X、W分别投入等体积、等物质的量浓度的盐酸中,都有气体产生,W比X反应剧烈 |
| 实验3 | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
A.金属的活动性顺序:Y>Z>X>W
B.实验1中,Y作正极
C.Z放入CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸可构成原电池,X作正极
下列叙述中正确的是
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 |
| C.马口铁(镀锡铁)破损时与电解质溶液接触锡先被腐蚀 |
| D.原电池工作时,电解质溶液中的阴离子向负极移动 |
锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是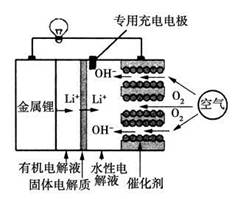
| A.该电池放电时,正极的反应式为O2+4e-+4H+===2H2O |
| B.该电池充电时,阴极发生了氧化反应:Li++e-===Li |
| C.电池中的有机电解液可以用稀盐酸代替 |
| D.正极区产生的LiOH可回收利用 |
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是
A.在阴极式,发生的电极反应为:2H2O+2e- 2OH―+H2↑ 2OH―+H2↑ |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2 +2H+ +2H+  +H2O向右移动 +H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+2O2↑ 2K2Cr2O7+4KOH+2H2↑+2O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α= |



