题目内容
2.下列电离方程式错误的是( )| A. | NH3•H2O?NH4++OH- | B. | H2SO3?2H++SO32- | ||
| C. | Fe(OH)3?Fe3++3OH- | D. | H2SO4→2H++SO42- |
分析 A.一水合氨为弱电解质,在溶液中部分电离出铵根离子和氢氧根离子;
B.亚硫酸为二元弱酸,其电离过程分步进行,主要以第一步为主;
C.氢氧化铁为多余弱碱,其电离方程式直接一步写出即可;
D.硫酸为强电解质,在溶液中完全电离出氢离子和硫酸根离子.
解答 解:A.一水合氨为弱碱,在溶液中存在电离平衡,其电离方程式为:NH3•H2O?NH4++OH-,故A正确;
B.亚硫酸为二元弱酸,电离方程式应该分步写,主要写出第一步的电离即可,正确的电离方程式为:H2SO3?H++HSO3-,故B错误;
C.氢氧化铁为弱碱,在溶液中部分电离出铁离子和氢氧根离子,其电离方程式为:Fe(OH)3?Fe3++3OH-,故C正确;
D.硫酸为强电解质,在溶液中完全电离,其电离方程式为:H2SO4→2H++SO42-,故D正确;
故选B.
点评 本题考查了电离方程式的书写,为高考的高频题,题目难度中等,注意掌握电离方程式的书写原则,明确强弱电解质的判断方法为解答关键,B、C为易错点,注意明确多元弱酸、弱碱的电离方程式的书写方法.

练习册系列答案
相关题目
12.G.X.Y.Z.Q均为氯(Cl)的含氧化合物,它们有如下关系:
①G→Q+NaCl
②Q+H2O-→X+H2
③Y+NaOH→G+Q+H2O
④Z+NaOH→Q+X+H2O
这五种化合物中,氯的化合价由低到高的顺序是( )
①G→Q+NaCl
②Q+H2O-→X+H2
③Y+NaOH→G+Q+H2O
④Z+NaOH→Q+X+H2O
这五种化合物中,氯的化合价由低到高的顺序是( )
| A. | QGZYX | B. | GYQZX | C. | GYZQX | D. | ZXGYQ |
13.下列说法中不正确的是( )
| A. | 元素电负性越大的原子,吸引电子的能力越强 | |
| B. | 在NH4+ 和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 在晶体钋(简单立方堆积)中,每个钋原子周围紧密相邻的钋原子有8个 | |
| D. | CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为配位键 |
10.下列叙述不正确的是( )
| A. | 0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 | |
| C. | pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等 | |
| D. | 在NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO-)+c(H2CO3) |
17.下列物质中,不能用直接化合制取的是( )
| A. | Fe(OH)3 | B. | FeCl3 | C. | CuS | D. | FeCl2 |
11.下列有关实验操作或叙述错误的是( )
| A. | 实验室常用如图所示的装置制取少量的乙酸乙酯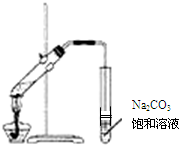 | |
| B. | 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 | |
| C. | 用玻璃棒搅拌漏斗中的液体以加快过滤的速度 | |
| D. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的上端倒出 |



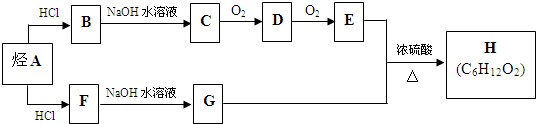

 .(用结构简式表示)
.(用结构简式表示)