题目内容
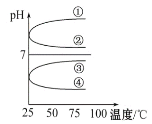
【题目】在某温度下,向20 mL 0.1 mol/L 某一元酸HA溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中一定正确的是

A. a点表示溶液中c(A-)为0.1 mol/L
B. a、b、c、d点表示的溶液中一定有:c(H+)·c(OH-)=1×10-14
C. c点表示HA和NaOH恰好反应完全
D. b、d点表示的溶液中,其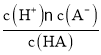 值一定不变
值一定不变
【答案】D
【解析】
A.0.1 mol/L 某一元酸HA溶液a点表示0.1 mol/L 某一元酸HA溶液的pH=3,说明为弱酸,溶液中c(A-)<0.1 mol/L,故A错误;
B.Kw= c(H+)·c(OH-),Kw与温度有关,未注明温度, a、b、c、d点表示的溶液中不一定有c(H+)·c(OH-)=1×10-14,故B错误;
C.根据图象可知,该酸为弱酸,若c点表示HA和NaOH恰好反应完全,则溶液应该显碱性,由于未注明温度,pH=7时,无法判断溶液的酸碱性和是否恰好完全反应,故C错误;
D.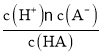 表示该弱酸的电离平衡常数,温度不变,平衡常数不变,故D正确;
表示该弱酸的电离平衡常数,温度不变,平衡常数不变,故D正确;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A。 | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液 | 紫色石蕊溶液滴入Na2O2中 | CCl4溶液滴入碘水 | Na在空气中放置 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变蓝,随后迅速褪色 | CCl4层由无色变为浅紫色 | 钠表面由银白色变暗 |
A.AB.BC.CD.D
【题目】【化学一选修3:物质结构与性质】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为 +7价 | 基态原子中,电子占据的最高能层符号为L,最高 能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1) W的基态原子电子排布式为____, X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5 (气态或液态时)中,中心原子的轨道类型不是sp3杂化的是________(填化学式,下同),分子构型是正四面体的是______, 属于极性分子的是____。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为____,Y与氢元素能形成YnH2n+2 (n为正整数)的一系列物质,这一系列物质沸点的变化规律以及影响的因素是______________。
(4)Z可形成多种含氧酸,如H3ZO4、HZO3、H3ZO3等,其中酸性最强的是______(填化学式)。
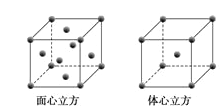
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为r cm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为_____gcm-3。