题目内容
【题目】【化学一选修3:物质结构与性质】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为 +7价 | 基态原子中,电子占据的最高能层符号为L,最高 能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1) W的基态原子电子排布式为____, X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5 (气态或液态时)中,中心原子的轨道类型不是sp3杂化的是________(填化学式,下同),分子构型是正四面体的是______, 属于极性分子的是____。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为____,Y与氢元素能形成YnH2n+2 (n为正整数)的一系列物质,这一系列物质沸点的变化规律以及影响的因素是______________。
(4)Z可形成多种含氧酸,如H3ZO4、HZO3、H3ZO3等,其中酸性最强的是______(填化学式)。
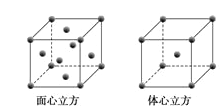
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为r cm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为_____gcm-3。
【答案】 [Ar]3d64s2 Cl> P> C PCl5 CCl4 PCl3 分子晶体 规律:随着相对分子质量的增大而升高,影响因素是分子间作用力的大小 HPO3 12 21![]() /(4NAr3)
/(4NAr3)
【解析】短周期只有Cl的最高正价为+7价,则X为Cl元素;Y基态原子中,电子占据的最高能层符号为L,最高 能级上只有两个自旋方向相同的电子,则其电子排布式为1s22s22p2,Y应为碳元素;Z核外电子共有15种运动状态,应为P元素;W能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应,可知W为Fe元素;
(1) Fe的核电荷数为26,其基态原子电子排布式为[Ar]3d64s2 ,Cl、C、P三种元素的非金属性强弱顺序为Cl> P> C,非金属性越强电负性越大,故电负性由大到小的顺序为Cl> P> C;
(2)化合物CCl4和PCl3的中心原子的杂化类型分别均sp3,而PCl5中P原子形成5个共用电子对,杂化类型不可能是sp3,CCl4为正四面体结构,为非极性分子,PCl3含有孤电子对,空间构型为锥形,为极性分子;
(3)已知FeCl3的沸点:319℃,熔点:306℃,沸点较低,则FeCl3的晶体类型为分子晶体,C与氢元素能形成CnH2n+2(n为正整数)的一系列物质,为烷烃,晶体类型为分子晶体,相对分子质量越大,分子间作用力越强,则沸点越高,;
(4)H3PO4、HPO3、H3PO3可改写成(HO)3RO、(HO)RO2、(HO)3R,非羟基氧原子个数分别为1、2、0,非羟基氧数目越多,酸性越弱,则酸性HPO3>H3PO4>H3PO3;
(5)Fe单质晶体为面心立方晶胞结构时,结构中Fe原子周围最靠近的Fe原子数目为12,则Fe的配位数为12;
若Fe为体心立方堆积,铁为与顶点和体心,则一个晶胞中Fe的个数为1+8×![]() =2,一个晶胞的质量为
=2,一个晶胞的质量为![]() ,体心结构中,体对角线长为4rcm,晶胞边长为
,体心结构中,体对角线长为4rcm,晶胞边长为![]() cm,晶胞的体积为(
cm,晶胞的体积为(![]() )3cm3,故密度为
)3cm3,故密度为![]() g/cm3=21
g/cm3=21![]() /(4NAr3)。
/(4NAr3)。
