题目内容
【题目】在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是

A. T ℃时,Ag2CrO4的Ksp为1×10-11
B. T ℃时,Y点和Z点的Ag2CrO4的Ksp相等
C. T ℃时 , X点的溶液不稳定,会自发转变到Z点
D. T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀
【答案】C
【解析】A、依据图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶解平衡为:Ag2CrO4(s)2Ag++CrO42-;Ksp=c2(Ag+)·c(CrO42-)=(10-3)210-5=10-11,A正确;B、溶度积常数随温度变化,不随浓度变化,所以t℃时,Y点和Z点时Ag2CrO4的Ksp相等,B正确;C、T ℃时,X点是过饱和溶液,变为饱和溶液的过程中,银离子与铬酸根离子浓度均降低,不会自发转变到Z点,C错误;D、0.01mol/L AgNO3溶液滴定20mL0.01mol/LKCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)= ![]() ,c(Cl-)=0.01mol/L,依据溶度积计算得到:c(Ag+)=1.8×1010÷0.01 mol/L=1.8×10-8mol/L,所以先析出氯化银沉淀,D正确;答案选C。
,c(Cl-)=0.01mol/L,依据溶度积计算得到:c(Ag+)=1.8×1010÷0.01 mol/L=1.8×10-8mol/L,所以先析出氯化银沉淀,D正确;答案选C。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】(1)已知NO2和N2O4可以相互转化N2O4 (g)![]() 2NO2 (g)△H=+57.2kJ/mol。t℃时,现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下表所示,据此回答相关问题:
2NO2 (g)△H=+57.2kJ/mol。t℃时,现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下表所示,据此回答相关问题:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(x)/mol·L-1 | 0.2 | C | 0.6 | 0.6 | 1.2 | C1 | C1 |
c(Y)/mol·L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | C2 | C2 |
①前10 min内用N2O4表示的化学反应速率v(N2O4)=__________,t℃时,该反应的化学平衡常数K=__________。
②20min时,若只改变了某一个条件,该条件可能是__________。
③t℃时,若开始时向容器中充入1mol的NO2、0.2mol N2O4,则v(正)________v(逆)(填“>”“<”或“=”)
(2)一定压强下,向10L密闭容器中充入1molS2Cl2和1molCl2,发生反应S2Cl2(g) + Cl2(g)![]() 2SCl2(g)。Cl2和SCl2的消耗速率(v)与温度(T)的关系如图所示:
2SCl2(g)。Cl2和SCl2的消耗速率(v)与温度(T)的关系如图所示:

①ABCD四点对应状态下,达到平衡状态的有__________。
②△H2_______0(填“>”“<”或“=”)
【题目】下列表格中各项分类都正确的一组是( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 冰水混合物 | CuSO45H2O | 液态KNO3 | 蔗糖 |
B | CaO | 海水 | 铜 | 酒精 |
C | 液氯 | 铝合金 | AgCl | CO2 |
D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
A.A
B.B
C.C
D.D
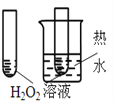
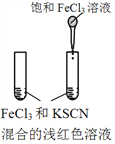
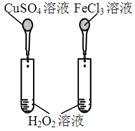
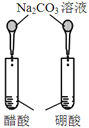
【题目】下图所示的实验,不能达到实验目的的是(各选项中对比溶液的浓度体积均相同)( )
实验方案 |
|
|
|
|
目的 | A.验证升高温度可加快H2O2分解 | B.验证增大反应物浓度对平衡的影响 | C.比较Cu2+、Fe3+对H2O2分解速率的影响 | D.比较弱酸的相对强弱 |
A. A B. B C. C D. D