题目内容
14.下列粒子半径最大的是( )| A. | Na+ | B. | P | C. | Cl | D. | F |
分析 Na+、F-电子层结构相同,核电荷数越大离子半径越小,氟原子半径小于氟离子半径,同周期自左而右原子半径减小,同主族自上而下原子半径增大.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径P>Cl>F,氟原子半径小于氟离子半径,Na+、F-电子层结构相同,核电荷数越大离子半径越小,故离子半径:Na+<F-,故P原子半径最大,故选B.
点评 本题考查微粒半径比较,难度不大,掌握微粒比较比较规律即可解答,有利于基础知识的巩固.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
4.下列关于胶体和溶液的说法中,正确的是( )
| A. | 许多胶体能进行电泳是因为这些胶体带电 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 |
2.物质之间发生化反应时,一定发生变化的是( )
| A. | 颜色 | B. | 状态 | C. | 能量 | D. | 原子核 |
9.有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断不正确的是( )
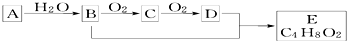

| A. | 鉴别A和甲烷可选择酸性高锰酸钾溶液 | |
| B. | B、D均能与金属钠反应 | |
| C. | 物质C的结构简式为CH3CHO | |
| D. | B+D→E的化学方程式为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5 |
19.已知一定温度下,N2 和H2反应生成2mol NH3时放出的热量为92.0kJ,将1mol N2 和3mol H2 放在一密闭容器中进行反应,反应结束后测得放出的热量为(忽略能量损失)( )
| A. | 一定大于92.0 kJ | B. | 一定等于92.0 kJ | C. | 一定小于92.0 kJ | D. | 不能确定 |
6.对于可逆反应M(g)+N(g)?Q(g)达到平衡时,下列说法正确的是( )
| A. | M、N、Q三种物质的浓度一定相等 | |
| B. | M、N全部变成了Q | |
| C. | 反应混合物各成分的百分组成不再变化 | |
| D. | 反应已经停止 |
3.下列说法中正确的是( )
| A. | 等温等压下,aLO2与bLO3混合后得到混合气体的体积为(a+b)L | |
| B. | 配制100mL 0.2mol/LCuSO4溶液,需称取CuSO4•5H2O的质量为5.0 g | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 向某溶液中滴加BaCl2溶液,产生白色沉淀,继续滴加稀盐酸沉淀不溶解,说明原溶液中一定含有SO42- |
4.在汽车加油站见到的油罐车上,所贴的危险化学品标志是( )
| A. |  腐蚀品 | B. |  爆炸品 | C. |  有毒气体 | D. |  易燃液体 |