题目内容
19.已知一定温度下,N2 和H2反应生成2mol NH3时放出的热量为92.0kJ,将1mol N2 和3mol H2 放在一密闭容器中进行反应,反应结束后测得放出的热量为(忽略能量损失)( )| A. | 一定大于92.0 kJ | B. | 一定等于92.0 kJ | C. | 一定小于92.0 kJ | D. | 不能确定 |
分析 N2 和H2反应生成2mol NH3时放出的热量为92.0kJ,是指1mol氮气和1mol的氢气完全反应生成2mol的氨气放出的热量为92.0kJ,1mol N2 和3mol H2 放在密闭容器中不可能完全转化为氨气,由此分析解答.
解答 解:N2 和H2反应生成2mol NH3时放出的热量为92.0kJ,是指1mol氮气和1mol的氢气完全反应生成2mol的氨气放出的热量为92.0kJ,1mol N2 和3mol H2 放在密闭容器中不可能完全转化为氨气,所以放出热量一定小于92.0 kJ,故选C.
点评 本题考查根据反应热大小的计算,题目难度不大,注意反应的可逆性,可逆反应永远是反应物和生成物共存的体系.

练习册系列答案
相关题目
9.在水溶液中能大最共存的一组离子是( )
| A. | Fe2+、Al3+、ClO-、Cl- | B. | K+、Cu2+、OH-、NO3- | ||
| C. | Na+、Ba+、Cl-、NO3- | D. | Mg2+、H+、SO42-、SiO32- |
10.下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
请用具体的元素符号填写下面空格:
(1)以上元素中,第一电离能最大的是Ar;电负性最大的金属是O.
(2)i、j、l 三种元素最高价氧化物对应的水化物中,酸性最强的是HClO4
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成几个区域,其中,元素c、m分别位于ds区、p区.
(4)下表是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量Li原子失去1个电子后形成稳定结构,再失去1个电子很困难
②表中X可能为以上元素中的Al元素.用元素符号表示a和h形成化合物的电子式是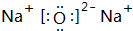 和
和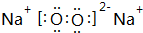 .
.
| b | |||||||||||||||||
| h | |||||||||||||||||
| a | f | i | j | l | m | ||||||||||||
| e | c | g | |||||||||||||||
(1)以上元素中,第一电离能最大的是Ar;电负性最大的金属是O.
(2)i、j、l 三种元素最高价氧化物对应的水化物中,酸性最强的是HClO4
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成几个区域,其中,元素c、m分别位于ds区、p区.
(4)下表是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
| 锂 | X | |
| 第一电离能 | 519 | 580 |
| 第二电离能 | 7296 | 1820 |
| 第三电离能 | 11799 | 2750 |
| 第四电离能 | 11600 |
②表中X可能为以上元素中的Al元素.用元素符号表示a和h形成化合物的电子式是
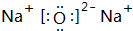 和
和 .
.
7.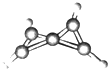 科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是( )
科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是( )
 科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是( )
科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是( )| A. | 烃X的分子式为C5H4 | |
| B. | 分子中只有一种类型的H原子 | |
| C. | 烃X在一定条件下能发生加成反应 | |
| D. | X分子中只有碳碳单键,没有碳碳双键 |
14.下列粒子半径最大的是( )
| A. | Na+ | B. | P | C. | Cl | D. | F |
4.下列各组物质的燃烧热相等的是( )
| A. | 碳和二氧化碳 | B. | 1mol碳和3mol碳 | ||
| C. | 3mol乙炔和1mol苯 | D. | 淀粉和纤维素 |
11.下列有关氯气的说法正确的是( )
| A. | 氯气是黄绿色气体,有毒,有刺激性气味,不能溶于水 | |
| B. | 将氯气持续通入紫色石蕊试液中,现象是石蕊试液先变红后褪色 | |
| C. | 红热的铜丝在Cl2 中燃烧产生棕黄色的雾;H2 在Cl2 中燃烧,火焰呈淡蓝色 | |
| D. | 氯水长时间放置不会变质,还可消毒杀菌 |
8.现有三组化合物:①汽油和氯化钠溶液 ②乙醇的水溶液 ③溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、蒸发、萃取 | B. | 分液、蒸馏、萃取 | C. | 萃取、蒸发、分液 | D. | 萃取、分液、蒸馏 |
9.下列属于取代反应的是( )
| A. | H2C=CH2+H2$\stackrel{催化剂}{→}$H3C-CH3 | B. | 2CH3CH2OH+O2$\stackrel{Cu/△}{→}$2CH3CHO+2H2O | ||
| C. | 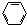 +3H2$\stackrel{Ni/△}{→}$ +3H2$\stackrel{Ni/△}{→}$ | D. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl |