题目内容
【题目】浓硫酸与木炭粉在加热条件下反应:C+H2SO4(浓)![]() CO2↑+SO2↑+2H2O
CO2↑+SO2↑+2H2O
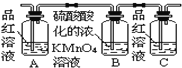
Ⅰ.第一小组用如图所示各装置设计一个实验,验证上述反应所产生的三种产物。
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
(1)这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):④→ → → 。___
(2)实验时可观察到装置A瓶的溶液褪色,C瓶的溶液不褪色;A瓶溶液变化体现了SO2___性;B瓶溶液的作用是___,B瓶中对应反应的离子方程式是___;C瓶溶液的作用是___。
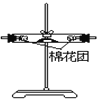
(3)装置②中看到现象是___。
(4)装置③中所加试剂名称是___,现象是___。
Ⅱ.另一个小组为测得CO2和SO2的质量,并计算两者物质的量之比,设计下列实验:
将生成气体依次通过X溶液→浓硫酸→碱石灰1→碱石灰2,并设法让气体完全被吸收。
(5)下列试剂中适合充当X的是___
A.BaCl2溶液 B.Ba(OH)2溶液
C.滴加H2O2的BaCl2溶液 D.滴加H2O2的Ba(OH)2溶液
(6)实验结束后,在X溶液中得到的沉淀通过过滤、洗涤、烘干、称重,称得质量为4.66g。称得碱石灰1(足量)在实验前后增重质量为1.32g。CO2和SO2物质的量比___。
【答案】④→②→①→③ 漂白 除去二氧化硫,避免对检验二氧化碳造成干扰 5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+ 确认二氧化硫已除尽 固体由白色变蓝色 澄清石灰水 溶液变浑浊 C 3:2
【解析】
(1)反应得到的三个气态产物是SO2、CO2和H2O,用无水硫酸铜检验H2O,用品红溶液检验SO2,用澄清石灰水检验CO2;
(2)二氧化硫具有漂白性,能使品红褪色,二氧化硫能被高锰酸钾溶液氧化为SO42-,C瓶的溶液不褪色,可证明二氧化硫已除尽;
(3)无水硫酸铜遇水变蓝;
(4)装置③用来检验二氧化碳,二氧化碳使澄清石灰水变浑浊;
(4)X只能与二氧化硫反应,不能与二氧化碳反应;
(6)实验结束后,在X溶液中得到的沉淀硫酸钡的质量为4.66g,碱石灰1(足量)吸收二氧化碳质量为1.32g。
实验的目的是要将三种气态产物一一验证出来.由题中所给的各种装置可知:④是反应发生器;①中有品红溶液,可联想用来验证SO2;装置③中装有某种水溶液,显然③可用来验证CO2;②装入无水硫酸铜可验证水气,由于①、③中装的都是水溶液,气流经过后一定会带出水气,所以必须先用②验证产物中的水气,然后再验证SO2和CO2,不然就不能验证水气一定是反应产物;由于SO2和CO2都能与石灰水反应,使澄清的石灰水变浑浊,因此从②出来的气体必须先经过①验证和除去SO2后再进入③验证CO2,由此可以得出正确的连接顺序应当是④→②→①→③;
(2)二氧化硫能使品红褪色,A瓶的溶液褪色,体现了SO2的漂白性;二氧化硫能被高锰酸钾溶液氧化为SO42-,B瓶溶液的作用是除去二氧化硫,避免对检验二氧化碳造成干扰,B瓶中反应的离子方程式是5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;C瓶的溶液不褪色,可证明二氧化硫已除尽,C瓶溶液的作用是确认二氧化硫已除尽。
(3)装置②中装入无水硫酸铜,看到现象是固体由白色变蓝色;
(4)装置③用来检验二氧化碳,装入的试剂是澄清石灰水,二氧化碳使澄清石灰水变浑浊,装置③的现象是溶液变浑浊;
(4)A.BaCl2溶液与二氧化硫、二氧化碳都不反应,故不选A;
B.Ba(OH)2溶液与二氧化硫、二氧化碳都能反应,故不选B;
C. SO2被H2O2氧化为H2SO4,H2SO4与的BaCl2反应生成硫酸钡沉淀,二氧化碳不反应,故选C;
D.滴加H2O2的Ba(OH)2溶液与二氧化硫、二氧化碳都能反应,故不选D。
(6)实验结束后,在X溶液中得到的沉淀硫酸钡的质量为4.66g,硫酸钡的物质的量为0.02mol,根据硫元素守恒,SO2的物质的量是0.02mol,碱石灰1(足量)吸收二氧化碳质量为1.32g,二氧化碳的物质的量是![]() 0.03mol, CO2和SO2物质的量比3:2。
0.03mol, CO2和SO2物质的量比3:2。