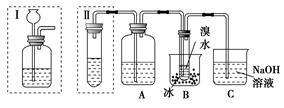
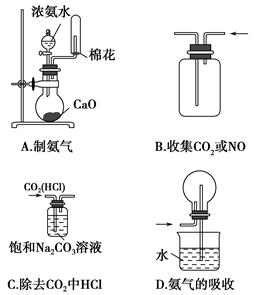
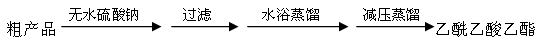题目内容
用下列各组仪器或装置,不能达到实验目的的是
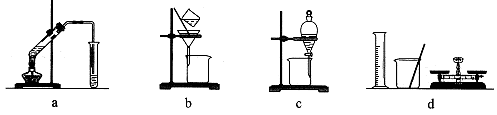

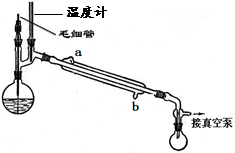
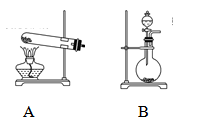
| A.a组:制备少量乙酸乙酯 |
| B.b组:除去粗盐水中的泥沙 |
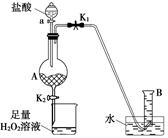
| C.c组:用CCl4提取碘水中的碘 |
| D.d组:配制100 mL 1.00 mol/L NaCl溶液 |
D
试题分析:A、乙酸、乙醇和浓硫酸在试管中共热制取乙酸乙酯,用饱和碳酸钠溶液吸收,正确;B、除去液体中的不溶固体用过滤的方法,正确;C、碘易溶于四氯化碳,四氯化碳与水互不相溶,溶液分层,用分液的方法将其分离,正确;D、配制溶液除所给仪器外,还需要100mL的容量瓶,错误,答案选D。

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
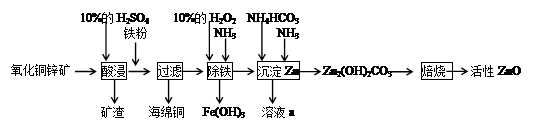
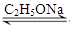 CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下: