题目内容
Ⅰ、某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3,乙同学认为沉淀是CuCO3和Cu(OH)2的混合物。他们设计实验通过测定沉淀中CuCO3的质量分数来确定沉淀的组成。
(1)按照甲同学的观点,发生反应的离子方程式为: 。
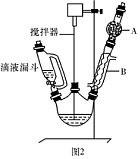
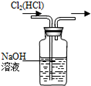
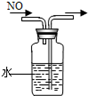
(2)两同学利用下图所示装置进行测定:
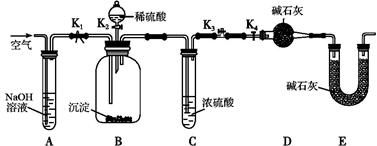
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为_____、_____、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K2、K4,打开K1、K3,通入过量空气
b.关闭K1、K3,打开K2、K4,充分反应
c.关闭K2、K3,打开K1、K4,通入过量空气
若沉淀质量为m,C中浓硫酸增重x,D中碱石灰增重为y,则CuCO3的质量分数为______。若未进行步骤a,将使测量结果 。
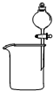
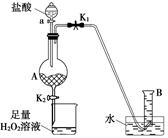
Ⅱ、某同学设计右图所示装置(夹持装置略,气密性已检验),用废铁屑来制取FeCl3·6H2O晶体。其操作步骤如下:
①打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸至过量。
②当……时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
③将烧杯中含有盐酸的溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3·6H2O晶体。
请回答:
(1)步骤②中“……”的内容是_____。
(2)写出A中溶液进入烧杯后发生反应的离子方程式:____。
(3)步骤③烧杯中溶液里盐酸的作用是____。

(1)按照甲同学的观点,发生反应的离子方程式为: 。
(2)两同学利用下图所示装置进行测定:

①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为_____、_____、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K2、K4,打开K1、K3,通入过量空气
b.关闭K1、K3,打开K2、K4,充分反应
c.关闭K2、K3,打开K1、K4,通入过量空气
若沉淀质量为m,C中浓硫酸增重x,D中碱石灰增重为y,则CuCO3的质量分数为______。若未进行步骤a,将使测量结果 。
Ⅱ、某同学设计右图所示装置(夹持装置略,气密性已检验),用废铁屑来制取FeCl3·6H2O晶体。其操作步骤如下:
①打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸至过量。
②当……时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
③将烧杯中含有盐酸的溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3·6H2O晶体。
请回答:
(1)步骤②中“……”的内容是_____。
(2)写出A中溶液进入烧杯后发生反应的离子方程式:____。
(3)步骤③烧杯中溶液里盐酸的作用是____。
Ⅰ、(1)根据题意可得方程式为:Cu2++2HCO3-=CuCO3↓+CO2↑+H2O;
(2)①过滤;洗涤;② 防止空气中CO2和水蒸气进入装置D(或进入干燥管);
③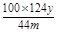 %(或
%(或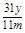 ) ;偏高;
) ;偏高;
Ⅱ、(1)A中固体完全消失;(2)2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)盐酸可抑制FeCl3水解,防止产生Fe(OH)3沉淀;
(2)①过滤;洗涤;② 防止空气中CO2和水蒸气进入装置D(或进入干燥管);
③
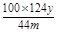 %(或
%(或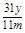 ) ;偏高;
) ;偏高;Ⅱ、(1)A中固体完全消失;(2)2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)盐酸可抑制FeCl3水解,防止产生Fe(OH)3沉淀;
试题分析:Ⅰ、(1)Cu2++2HCO3-=CuCO3↓+CO2↑+H2O;(2)①将沉淀从溶液中分离并净化。具体操作依次为过滤;洗涤;干燥。②装置D中的碱石灰吸收反应产生的CO2,通过测定其质量的多少来确定是否含有CuCO3及其含量的多少,若空气的成分进入,就会导致实验的误差,因此装置E中碱石灰的作用是吸收空气中的CO2和水蒸气,防止空气中CO2和水蒸气进入装置D(或进入干燥管);③CuCO3的质量分数为m(CuCO3)÷m(总)×100%={(y÷44)×124}÷x×100%=
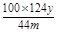 %(或
%(或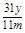 )若未进行步骤a,由于空气中含有CO2,会把空气中的二氧化碳当作是CuCO3反应产生的。所以将使测量结果偏高。Ⅱ(1)根据题意可知:步骤②中“……”的内容是待A中固体完全消失时。(2)FeCl2与H2O2反应的方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。(3)FeCl3是强碱弱酸盐,Fe3+水解使溶液而得到Fe(OH)3沉淀。所以为了抑制FeCl3水解,防止产生Fe(OH)3沉淀要加入适量的盐酸。
)若未进行步骤a,由于空气中含有CO2,会把空气中的二氧化碳当作是CuCO3反应产生的。所以将使测量结果偏高。Ⅱ(1)根据题意可知:步骤②中“……”的内容是待A中固体完全消失时。(2)FeCl2与H2O2反应的方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。(3)FeCl3是强碱弱酸盐,Fe3+水解使溶液而得到Fe(OH)3沉淀。所以为了抑制FeCl3水解,防止产生Fe(OH)3沉淀要加入适量的盐酸。
练习册系列答案
相关题目
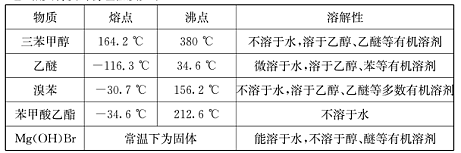
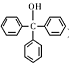 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。