题目内容
10.已知NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 46g甘油中存在的共价键总数为6.5NA | |
| B. | 标准状况下,50mL12mol/L盐酸与足量MnO2共热,可产生3.36LCl2 | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
分析 A.甘油为丙三醇,其分子中2个碳碳键、5个碳氢键、3个碳氧键和3个氧氢键,总共含有13个共价键;
B.浓盐酸与二氧化锰的反应中,浓盐酸变成稀盐酸反应停止,则反应生成的氯气减少;
C.过氧化钠中氧元素的化合价为-1价,生成0.1mol氧气转移了0.2mol电子;
D.一氧化氮与氧气反应生成二氧化氮,部分二氧化氮转化成四氧化二氮,导致分子数减少.
解答 解:A.46g丙三醇的物质的量为:$\frac{46g}{92g/mol}$=0.5mol,0.5mol丙三醇中含有1mol碳碳键、2.5mol碳氢键、1.5mol碳氧键和1.5mol氧氢键,总共含有6.5mol共价键,存在的共价键总数为6.5NA,故A正确;
B.50mL 12mol/L盐酸中含有0.6mol氯化氢,消耗0.6mol氯化氢最多生成1.5mol氯气,由于随着反应的进行,浓盐酸变成稀盐酸,反应会停止,则反应生成的氯气的物质的量小于1.5mol,反应放出的氯气在标况下的体积小于3.36L,故B错误;
C.过氧化钠与水反应时,生成0.1mol氧气转移了0.2mol电子,转移的电子数为0.2NA,故C错误;
D.2molNO与1molO2充分反应生成2mol二氧化氮,由于部分二氧化氮转化成四氧化二氮,则反应产物的物质的量小于2mol,产物的分子数小于2NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;B为易错点,注意稀盐酸不与二氧化锰反应.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
2.下列离子方程式中,正确的是( )
| A. | 氧化亚铁和稀硝酸反应FeO+2H+═Fe2++H2O | |
| B. | 硫酸铝溶液与足量烧碱:Al3++3OH-=Al(OH)3↓ | |
| C. | 氯化亚铁溶液中滴入氯水Cl2+2Fe2+═2Cl-+2Fe3+ | |
| D. | 金属铝投入NaOH溶液中2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+2H2↑ |
17.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+数为2NA | |
| C. | 42g乙烯和丙烯的混合气体充分燃烧消耗氧气的分子数为4.5 NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题: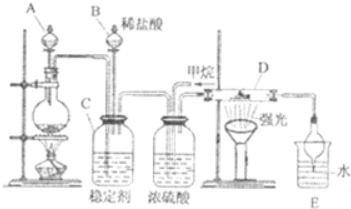 氯及其化合物在合成消毒剂、药物等方面具有广泛用途.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,某兴趣小组通过如图装置,对二氧化氯及氯气的性质进行了研究:
氯及其化合物在合成消毒剂、药物等方面具有广泛用途.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,某兴趣小组通过如图装置,对二氧化氯及氯气的性质进行了研究: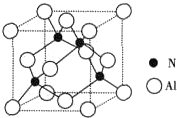
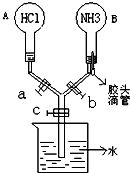 如图所示的装置,实验前a、b、c活塞均关闭.
如图所示的装置,实验前a、b、c活塞均关闭.