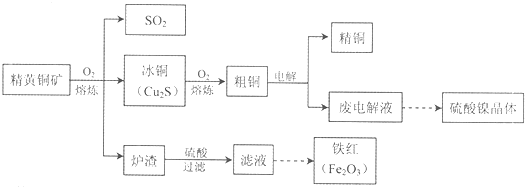
题目内容
10.沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用.难溶物在水中溶解达到饱和时,即建立沉淀溶解平衡,平衡常数称为溶度积(Ksp).已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9.(1)将浓度均为0.1mol•L-1的BaCl2溶液与Na2SO4溶液等体积混,充分搅拌后过滤,滤液中c(Ba2+)=1×10-5mol•L-1.取100mL滤液与100mL 2mol•L-1的Na2SO4溶液混合,混合液中c(Ba2+)=1×10-10mol•L-1.
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂.胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是对于平衡BaSO4(s)?Ba2+(aq)+SO42-(aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动 (用沉淀溶解平衡原理解释).万一误服了少量BaCO3,应尽快用大量0.5mol•L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变,残留在胃液中的Ba2+浓度仅为2×10-10mol•L-1.
(3)长期使用的锅炉需要定期除水垢,否则会降低燃料的用率.水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去.
①CaSO4转化为CaCO3的离子方程式为CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq);
②请分析CaSO4转化为CaCO3的原理:CaSO4存在沉淀溶解平衡,加入Na2CO3溶液后,CO32-与Ca2+结合生成CaCO3沉淀Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动.
分析 (1)根据Ksp(BaSO4)=1×10-10计算;
(2)从影响难溶电解质的溶解平衡的角度分析,结合溶度积计算;
(3)①CaSO4 转化为CaCO3的离子方程式为CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq);
②从沉淀的转化角度分析.
解答 解:(1)将浓度均为0.1mol/L的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中为饱和溶液,则存在:c(Ba2+)×c(SO42-)=1×10-10,c(Ba2+)=1×10-5mol/L;
取100mL滤液与100mL2mol/LNa2SO4的溶液混合,反应后c(SO42-)=1mol/L,则由c(Ba2+)×c(SO42-)=1×10-10可知:c(Ba2+)=1×10-10mol/L,
故答案为:1×10-5;1×10-10;
(2)由平衡BaSO4(s)?Ba2+(aq)+SO42-(aq)可知,H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动,
c(SO42-)=0.5mol/L,则由c(Ba2+)×c(SO42-)=1×10-10可知:c(Ba2+)=$\frac{1×1{0}^{-10}}{0.5}$=2×10-10mol/L,
故答案为:对于平衡BaSO4(s)?Ba2+(aq)+SO42-(aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动;2×10-10;
(3)①CaSO4 转化为CaCO3的离子方程式为CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),
故答案为:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq);
②由平衡CaSO4(s)?Ca2+(aq)+SO42-(aq)可知,加入Na2CO3溶液后,CO32-与Ca2+结合生成CaCO3沉淀Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动,发生:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),
故答案为:CaSO4存在沉淀溶解平衡,加入Na2CO3溶液后,CO32-与Ca2+结合生成CaCO3沉淀Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动.
点评 本题考查难溶电解质的溶解平衡,题目难度较大,解答本题时注意根据溶度积计算,把握平衡移动原理,注重相关知识、方法的理解和把握.

 阅读快车系列答案
阅读快车系列答案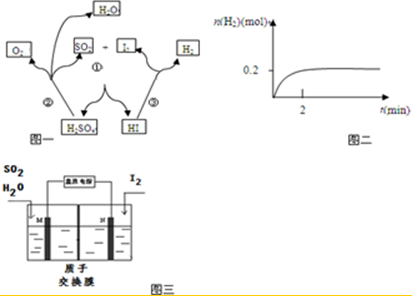
(1)写出反应③的化学方程式2HI?H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图二所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
I.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
II. 调节pH并连续搅拌24小时
III.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1 223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
| 温度 | 元素存在形式 |
| 1 200-1 350K | Fe3+部分转变为Fe2+ |
(5)由于该循环中H2SO4 与HI发生副反应造成反应器堵塞,因此有科学家用图三所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
| A. | 煤 | B. | 石油 | C. | 氢气 | D. | 天然气 |
| A. | 铝的摩尔质量为27g | |
| B. | 常温常压下,46g NO2中含有的氧原子数为2NA | |
| C. | 标准状况下,22.4L水中所含有的水分子数NA | |
| D. | 0.1mol•L-1的MgCl2溶液中氯离子物质的量浓度为0.1mol•L-1 |
| A. | Cl-离子的结构示意图: | |
| B. | 中子数为18的氯原子:${\;}_{17}^{35}$Cl | |
| C. | 铁在氯气中燃烧:Fe+Cl2=FeCl2 | |
| D. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 |