题目内容
1.黄铜矿(CuFeS2)是用于制取铜及其化合物的主要原料之一,还可以制备硫、铁和镍的化合物.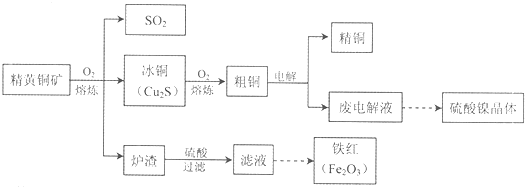
回答下列问题:
(1)冰铜熔炼过程发生的主要反应为:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ•mol-1
在熔炼过程中不需要持续加热,原因是2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1为放热反应,反应放出的热量可以维持反应进行.
(2)熔炼过程中产生的大量SO2(填分子式),可进一步加工并作为上述流程中的原料加以循环利用.
(3)炉渣的主要成分是Fe2O3、FeO、Al2O3、SiO2,为了得到铁红,需对上述滤液进行处理,处理过程涉及下列步骤中的ACD(填序号).A.氧化 B.还原 C.灼烧 D.加碱
(4)废电解液中含有较多的Ni2+,从废电解液提取硫酸镍晶体,需用电解法把电解液中的Cu2+除去,电解的阳极可以采用石墨作为电极材料,阳极的电极反应式是4OH--4e-=2H2O+O2↑.
(5)从废电解液中除去Pb2+的方法是往其中通人H2S至饱和,使Pb2+转化为硫化物沉淀,溶液的pH对转化效果的影响是溶液pH越大,转化效果越好.
已知:H2S饱和溶液中c(H2S)为0.1mol/L,$\frac{{c}^{2}({H}^{+})×c({S}^{2-})}{c({H}_{2}S)}$=10-20;NiS的Ksp=10-11.
若废电解液的pH=5,为保证不生成NiS沉淀,Ni2+浓度应控制在1mol/L以下.
分析 (1)2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)为放热反应,提供的热量可以维持反应进行;
(2)熔炼过程中产生的大量二氧化硫,可以用于制备硫酸;
(3)二氧化硅不与硫酸反应,过滤除去,得到滤液中含有硫酸铁、硫酸亚铁、硫酸铝及过量的硫酸,再将亚铁离子氧化为铁离子,最后加热过滤的氢氧化钠使铝离子转化为偏铝酸根、使铁离子转化为氢氧化铁沉淀,过滤、洗涤、灼烧得到氧化铁;
(4)由电解方法除去Cu2+,Cu2+发生还原反应,在阴极放电,阳极可以为惰性电极,阳极是氢氧根离子放电生成水与氧气;
(5)溶液中S2-浓度越大,Pb2+沉淀越完全,溶液pH越大,越有利于硫化氢电离平衡右移得到S2-;
根据$\frac{{c}^{2}({H}^{+})×c({S}^{2-})}{c({H}_{2}S)}$=10-20计算溶液中c(S2-),在根据NiS的Ksp=c(S2-)×c(Ni2+)=10-11 计算Ni2+应控制的浓度.
解答 解:(1)2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1为放热反应,反应放出的热量可以维持反应进行,在熔炼过程中不需要持续加热,
故答案为:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1为放热反应,反应放出的热量可以维持反应进行;
(2)熔炼过程中产生的大量二氧化硫,可以用于制备硫酸,进行循环利用,
故答案为:SO2;
(3)二氧化硅不与硫酸反应,过滤除去,得到滤液中含有硫酸铁、硫酸亚铁、硫酸铝及过量的硫酸,再将亚铁离子氧化为铁离子,最后加热过滤的氢氧化钠使铝离子转化为偏铝酸根、使铁离子转化为氢氧化铁沉淀,过滤、洗涤、灼烧得到氧化铁,
故选:ACD;
(4)由电解方法除去Cu2+,Cu2+发生还原反应,在阴极放电,阳极可以为惰性电极,可以是石墨,阳极是氢氧根离子放电生成水与氧气,电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:石墨;4OH--4e-=2H2O+O2↑;
(5)溶液中S2-浓度越大,Pb2+沉淀越完全,溶液pH越大,越有利于硫化氢电离平衡右移得到S2-,故溶液pH越大,转化效果越好;
若废电解液的pH=5,H2S饱和溶液中c(H2S)为0.1mol/L,则溶液中c(S2-)=$\frac{1{0}^{-20}×0.1}{(1{0}^{-5})^{2}}$mol/L=10-11mol/L,根据NiS的Ksp=c(S2-)×c(Ni2+)=10-11,可知c(Ni2+)<$\frac{Ksp(NiS)}{c({S}^{2-})}$=1mol/L,
故答案为:溶液pH越大,转化效果越好;1mol/L.
点评 本题考查物质制备实验,涉及对操作的分析评价、对原理的分析、物质分离提纯、电解应用、沉淀转化等,需要学生具备扎实的基础与灵活运用知识能力,难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案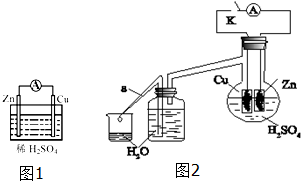 将锌片和铜片插入稀硫酸中构成如图1所示的装置,请回答下列问题:
将锌片和铜片插入稀硫酸中构成如图1所示的装置,请回答下列问题:(1)该装置可以实现化学能转化为电能(填能量转化形式).
(2)对该装置下列说法正确的是bd.
a.Cu为正极发生氧化反应
b.负极反应为 Zn-2e-═Zn2+
c.电子由铜片通过导线流向锌片
d.溶液中SO42-移向Zn极
(3)在反应中若为了减缓反应速率但不减少产生氢气的量,可以采取的措施ac(填序号).
a.加水 b.加少量氯化钡固体 c.加少量醋酸钠固体 d.加少量氢氧化钠固体
(4)某学生为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行如图2实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
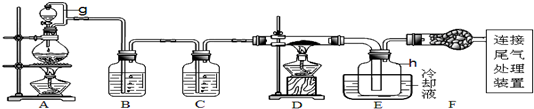
 某小组以工业氧化铁、草酸、盐酸、异丙醚为原料,合成晶体X[化学式为Fe2(C2O4)3•5H2O],并确定其纯度.
某小组以工业氧化铁、草酸、盐酸、异丙醚为原料,合成晶体X[化学式为Fe2(C2O4)3•5H2O],并确定其纯度.