题目内容
5.碘硫化学循环原理如图一所示.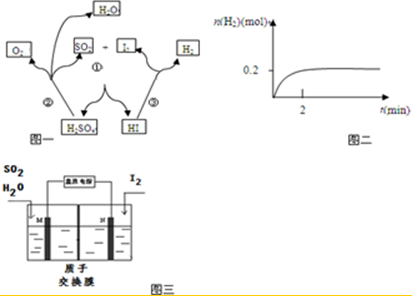
(1)写出反应③的化学方程式2HI?H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图二所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
I.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
II. 调节pH并连续搅拌24小时
III.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1 223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
| 温度 | 元素存在形式 |
| 1 200-1 350K | Fe3+部分转变为Fe2+ |
(5)由于该循环中H2SO4 与HI发生副反应造成反应器堵塞,因此有科学家用图三所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
分析 (1)由图可知碘化氢分解生成单质碘和氢气; 结合图象,利用三段式求出各物质平衡时的浓度,然后由平衡常数K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$计算;
(2)反应①为二氧化硫与单质碘反应生成HI和硫酸;反应中S元素的化合价升高,作还原剂;
(3)二氧化硫和水、碘单质发生反应生成硫酸、氢碘酸,而碘化氢分解生成碘和氢气;
(4)①由题意可知Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液反应生成CuFe2O4和KNO3,根据质量守恒配平;
②根据化合物种各元素的化合价的代数和为零计算;
(5)电解时二氧化硫在阳极失电子生成硫酸;碘单质在N极得电子生成碘离子,与氢离子结合形成HI.
解答 解:(1)由图可知碘化氢分解生成单质碘和氢气,其反应的方程式为:2HI?H2+I2;
2HI?H2+I2
起始(mol/L):1 0 0
转化(mol/L):0.2 0.1 0.1
平衡(mol/L):0.8 0.1 0.1
则K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$=$\frac{0.1×0.1}{0.{8}^{2}}$=$\frac{1}{64}$;
故答案为:2HI?H2+I2;$\frac{1}{64}$;
(2)反应①为二氧化硫与单质碘反应生成HI和硫酸,反应的方程式为:I2+SO2+2H2O=2HI+H2SO4,反应中S元素的化合价升高,则二氧化硫被氧化作还原剂,体现还原性;
故答案为:I2+SO2+2H2O=2HI+H2SO4;还原;
(3)二氧化硫和水、碘单质发生反应生成硫酸、氢碘酸,而碘化氢分解生成碘和氢气,所以该反应释放的能源气体为氢气,故答案为:H2;
(4)①Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液反应生成CuFe2O4和KNO3,其反应的方程式为2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O,
故答案为:2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O;
②设CuFe2O3.86中Fe3+个数为x,Fe2+的个数为y,
由化合价的代数和为零得:2+3x+2y+(-2)×3.86=0,x+y=2,
则解得:$\frac{x}{y}$=43:7,所以CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为 43:7;
故答案为:43:7;
(5)电解时二氧化硫在阳极失电子生成硫酸,其电极方程式为:SO2+2H2O-2e-=4H++SO42-;碘单质在N极得电子生成碘离子,M极附近产生的H+通过质子交换膜移动到N极附近,碘离子与氢离子结合形成HI,
故答案为:SO2+2H2O-2e-=4H++SO42-;M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
点评 本题是一道综合题,考查了化学平衡常数的计算、氧化还原反应概念、化学方程式的书写、电解原理的应用等,题目难度中等,侧重于考查学生对基础知识的综合应用能力,注意把握实验原理.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)请按照表中提示的信息,分别把符合左栏条件的物质的编号填人右栏相应的位置.
| 符合的条件 | 物质的编号 |
| 混合物 | ②⑤⑧ |
| 电解质,但熔融状态并不导电 | ③ |
| 电解质,但难溶于水,也不与水反应 | ⑨ |
| 非电解质 | ④⑥⑫ |
| 既不是电解质,也不是非电解质,但本身能导电 | ①②⑦ |
| A. | 元素原子的原子半径出现周期性变化 | |
| B. | 元素的化合价出现周期性变化 | |
| C. | 元素原子的电子层数出现周期性变化 | |
| D. | 元素原子的核外电子排布出现周期性变化 |
| A. | Cl | B. | Ne | C. | Li+ | D. | O |
| A. | 葡萄糖 | B. | 甘油 | C. | 尿素 | D. | 结晶牛胰岛素 |
 某小组以工业氧化铁、草酸、盐酸、异丙醚为原料,合成晶体X[化学式为Fe2(C2O4)3•5H2O],并确定其纯度.
某小组以工业氧化铁、草酸、盐酸、异丙醚为原料,合成晶体X[化学式为Fe2(C2O4)3•5H2O],并确定其纯度.